
| A、元素的非金属性越强,它的氧化物的水化物的酸性就越强 |
| B、同一主族元素的原子序数可以相差34 |
| C、硅和硫熔化时所克服的作用类型相同 |
| D、分子晶体中分子间作用力越大,沸点越高,分子越稳定 |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
| A、碳酸氢钠的电离方程式:NaHCO3═Na++H++CO32- |
| B、碳酸钙的沉淀溶解平衡表达式:CaCO3(s)?Ca2+(aq)+CO32-(aq) |
| C、氯化铝发生水解的离子方程式:Al3++3H2O═Al(OH)3+3H+ |
| D、亚硫酸的电离方程式:H2SO3?2H++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 熔点/℃ | 64.7 | 249 | 199.6 |
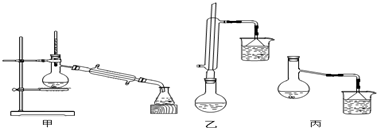
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
,(注:R,R′为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C为非气态 |
| B、C为气态 |
| C、第二次达到平衡时C为气态 |
| D、第三次达到平衡时C为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
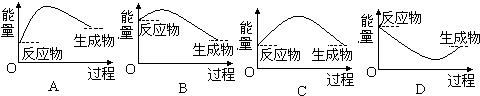
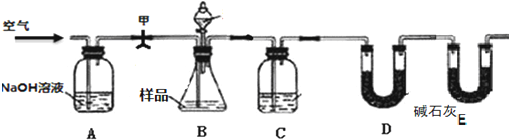
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
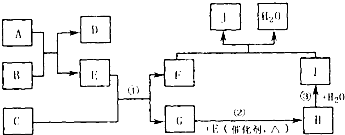
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com