
 CuSO4?(5-n)H2O+nH2O
CuSO4?(5-n)H2O+nH2O CuSO4?(1-n)H2O+nH2O
CuSO4?(1-n)H2O+nH2O CuSO4+H2O,
CuSO4+H2O, CuSO4+H2O.
CuSO4+H2O.

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
A.焦炭还原法 B.湿法炼铜 C.铝热还原法 D.电解冶炼法
查看答案和解析>>
科目:高中化学 来源: 题型:
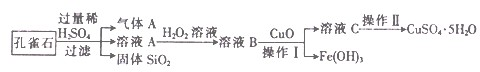
(10分)孔雀石的主要成分是CuCO3·Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。若要检验溶液A中Fe2+的最适宜选用的试剂为 ____ (填代号)。
a.KMnO4 b.铁粉 c.NaCl d.KSCN
(2)向溶液A中加入H2O2的目的是将溶液中的Fe2+氧化为Fe3+,写出该反应的离子方程式:_____________________________________________________;实验室选用H2O2而不用Cl2作氧化剂,除考虑环保因素外,另一原因是_____________________________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发, ,过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
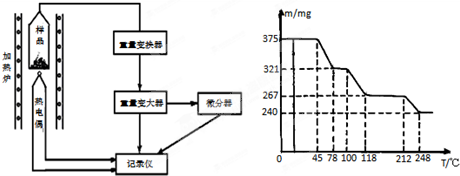
(4)将制得的胆矾样品用热重仪进行热重分析,热重仪原理及热重计录如下表:
写出212-248℃温度范围内发生反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年江苏省扬州市安宜高中高二上学期期末考试化学试卷 题型:实验题
(10分)孔雀石的主要成 分是CuCO3·Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
分是CuCO3·Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。若要检验溶液A中Fe2+的最适宜选用的试剂为 ____ (填代号)。
a.KMnO4 b.铁粉 c.NaCl d.KSCN
(2)向溶液A中加入H2O2的目的是将溶液中的Fe2+氧化为Fe3+,写出该反应的离子方程式:_____________________________________________________;实验室选用H2O2而不用Cl2作氧化剂,除考虑环保因素外,另一原因是_____________________________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发, ,过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该 仪器在此操作中的主要作用是 。
仪器在此操作中的主要作用是 。
(4)将制得的胆矾样品用热重仪进行热重分析,热重仪原理及热重计录如下表:
写出212-248℃温度范围内发生反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省扬州市高二上学期期末考试化学试卷 题型:实验题
(10分)孔雀石的主要成分是CuCO3·Cu(OH)2,还含有少量的SiO2和铁的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。若要检验溶液A中Fe2+的最适宜选用的试剂为 ____ (填代号)。
a.KMnO4 b.铁粉 c.NaCl d.KSCN
(2)向溶液A中加入H2O2的目的是将溶液中的Fe2+氧化为Fe3+,写出该反应的离子方程式:_____________________________________________________;实验室选用H2O2而不用Cl2作氧化剂,除考虑环保因素外,另一原因是_____________________________________。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发, ,过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(4)将制得的胆矾样品用热重仪进行热重分析,热重仪原理及热重计录如下表:

写出212-248℃温度范围内发生反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com