
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 A.用石墨作阳极,铁作阴极
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ +  5Cl-+ H2O
5Cl-+ H2O
【答案】D
【解析】A、阳极要产生ClO-,则铁只能作阴极,不能作阳极,否则就是铁失电子,A正确;B、阳极是Cl-失电子产生ClO-,电极反应式为:Cl- + 2OH--2e-= ClO- + H2O,B正确;C、阴极是H+产生H2,碱性溶液,故阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-,C正确;D、溶液为碱性,方程式应为2CN-+5ClO-+ H2O =N2↑+2CO2↑+5Cl-+2OH-。选D。
【考点定位】电化学基础知识
【名师点睛】原电池原理和电解池原理都是建立在氧化还原和电解质溶液基础上,借助氧化还原反应实现化学能与电能的相互转化,是高考命题重点,题目主要以选择题为主,主要围绕工作原理、电极反应的书写与判断、新型电池的开发与应用等进行命题。电化学的命题除在继续加强基本知识考查的基础上,更加注重了试题题材的生活化、实用化、情景化,同时也加强了不同知识间的相互渗透与融合,这与新课标所倡导的提高国民科学素养与探究、创新、灵活解决实际问题的能力极为相符,相信今后的电化学命题将会有更新颖的形式与题材出现。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A、苯酚、淀粉KI、乙酸、氢氧化钾四种溶液可用FeCl3溶液一次鉴别
B、CH3CH2OH、 CH2=CHCOOH、 CH3CHO、 CH3COOH四种溶液可用新制Cu(OH)2一次鉴别
C、KCl溶液中混有少量KI,可通入足量Cl2后,再用苯进行萃取、分液
D、制取乙酸乙酯,应先将乙醇、乙酸混合,后加入到浓硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
水杨酸最早取自柳树,其结构简式为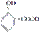 ,它的同分异构体很多,同时符合下列四个条件的同分异构体有多少种( )
,它的同分异构体很多,同时符合下列四个条件的同分异构体有多少种( )
①含有苯环 ②能发生银镜反应,不能发生水解反应 ③在稀NaOH溶液中1 mol该同分异构体能与2 mol NaOH发生反应 ④只能生成两种一氯代物
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池的电池反应式为:NaMO2 + nC  Na(1-x)MO2 + NaxCn ,下列有关该电池的说法正确的是( )
Na(1-x)MO2 + NaxCn ,下列有关该电池的说法正确的是( )
A、电池放电时,溶液中钠离子向负极移动
B、该电池负极的电极反应为:
NaMO2 — xe-  Na(1-x)MO2 + xNa+
Na(1-x)MO2 + xNa+
C、消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少
D、电池充电时的阳极反应式为:nC + x Na+ - xe-  NaxCn
NaxCn
查看答案和解析>>
科目:高中化学 来源: 题型:
 ⑴右图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,
⑴右图是部分主族元素第一电离能梯度图,图中,a点对应的元素为氢,
b、c两点对应的元素分别为 、 (填元素符号)。
⑵将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以
[Cr(H2O)5Cl]2+形式存在。
①上述溶液中,不存在的微粒间作用力是 (填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
 ⑶下面关于晶体的说法不正确的是________。
⑶下面关于晶体的说法不正确的是________。
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
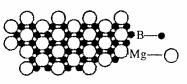
⑷硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,右图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为 。
⑸铁的金属密堆积方式为体心立方结构,结构如图所示。

则晶胞中铁原子的配位数为______。若铁原子的半径为r pm,写出该堆积方式的空间利用率的表达式(不要求算出结果)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
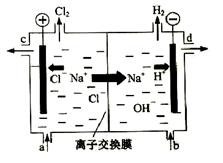
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式 。
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
|
化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ,电池反应的离子方程式为:
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和 ,欲从中得到较纯的MnO2,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为_____,加碱调节至pH为 时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是 ,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
可用于鉴别以下三种化合物的一组试剂是---------------------------------( )
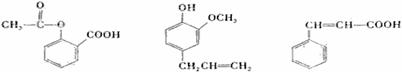
乙酰水杨酸 丁香酚 肉桂酸
①银氨溶液 ②溴的四氯化碳溶液 ③氯 化铁溶液 ④氢氧化钠溶液
化铁溶液 ④氢氧化钠溶液
A ②与③ B ③与④ C ①与④ D ①与②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com