
某课外研究小组用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为
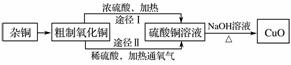
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________(填字母)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________________________________
科目:高中化学 来源: 题型:
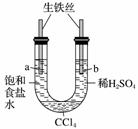 利用右图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
利用右图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,请回答有关问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||||
| 2 | ① | ② | ③ | |||||||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||
| 4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)④元素与⑦元素形成化合物的电子式 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 | 实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是( )
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A.0.21 mol B.0.25 mol
C.0.3 mol D.0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铁及其化合物的说法正确的是( )
A.将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质(2014·四川理综,4B)
B.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体(2014·重庆理综,3A)
C.1 mol FeI2与足量氯气反应时转移的电子数为2NA(2014·大纲全国卷,7A)
D.水溶液中Fe2+、H+、SO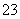 、ClO-不能大量共存(2014·广东理综,8B)
、ClO-不能大量共存(2014·广东理综,8B)
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
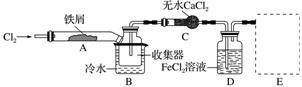
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为_________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是___________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为__________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:__________________________________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为___________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________________。
(8)综合分析实验 Ⅱ 的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
饮食是保证我们身体健康的基本需求,下列关于饮食的说法正确的是( )。
A.鸡蛋含有丰富的蛋白质,人类需要的蛋白质都可以由鸡蛋提供,多吃有益
B.水果、蔬菜含有丰富的维生素,有人为了减肥,每天只吃水果蔬菜即可
C.米饭含有大量的淀粉,成人每天食用量不能超过200 g
D.要促进身体健康,各种饮食必须合理搭配
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:
2NO2(g) 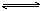 N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是 ( )
N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是 ( )
A.相对平均分子质量增大 B.NO2的转化率提高
C.NO2的质量分数增大 D.反应放出的总热量大于原来的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com