
| A. | 其它条件不变,增大压强,平衡不发生移动 | |
| B. | 该反应式中n值一定为2 | |
| C. | 其它条件不变,增大压强,混合气体的总质量不变 | |
| D. | 原混合气中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
分析 A.增大压强平衡向气体体积减小的分析移动;
B.C为固体,压强改变不影响C的浓度,不能确定n的值;
C.增大压强平衡向正反应方向移动,根据质量守恒定律判断混合气体的质量变化;
D.原混合气中A与B的物质的量之比为2:1,按2:1反应,混合气体中二者始终为2:1,二者的平均相对分子质量与D的相对分子质量相等,则混合气体的平均相对分子质量为定值.
解答 解:A.该反应正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,故A错误;
B.C为固体,压强改变不影响C的浓度,不能确定n的值,故B错误;
C.增大压强平衡向正反应方向移动,C的质量增大,C为固体,根据质量守恒定律可知,混合气体的质量减小,故C错误;
D.增大压强,测得混合气体的平均相对分子质量不变,说明混合气体的平均相对分子质量为定值,原混合气中A与B的物质的量之比为2:1,按2:1反应,混合气体中二者始终为2:1,二者的平均相对分子质量与D的相对分子质量相等,则混合气体的平均相对分子质量为定值,故D正确,
故选D.
点评 本题考查化学平衡的影响因素,难度不大,D选项关键是判断混合气体的平均相对分子质量为定值.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
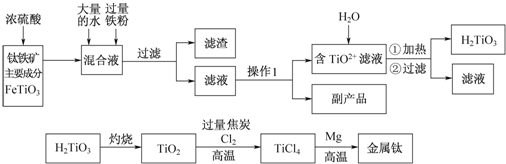
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

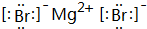
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
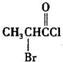 、
、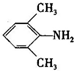 是合成施安卡因(
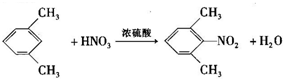
是合成施安卡因(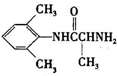 ,一种抗心律失学药物)的中间体,分别由如图所示路线合成:
,一种抗心律失学药物)的中间体,分别由如图所示路线合成: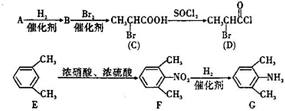 ,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.
,已知氨基(-NH2)、亚氨基(-NH-)均有碱性.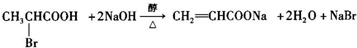 ;
; ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71gNa2SO4固体中含钠离子数目为NA | |
| B. | 28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA | |
| C. | 标准状况下,22.4LHF中含HF分子数目为NA | |
| D. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
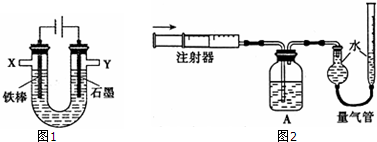
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 证明该溶液中一定含有大量的SO42- |
| C | 向某卤代烃中加入NaOH溶液,加热一段时间后,加入AgNO3溶液 | 检验卤代烃中的卤素原子 |
| D | 向纯碱中滴加足量盐酸,将产生的气体通入苯酚钠溶液 | 证明酸性:盐酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
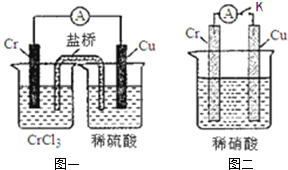 在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.
在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com