
下列说法正确的是()
A. HClO4中氯元素化合价比HClO中氯元素化合价高,所以,HClO4的氧化性强
B. 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
C. 已知还原性:B﹣>C﹣>D﹣,反应2C﹣+D2=2D﹣+C2和反应 2C﹣+B2=2B﹣+C2都能发生
D. 已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: A.同种元素的含氧酸,非羟基H的个数越多,酸性越强,不能比较氧化性;
B.强氧化性和强还原性的物质不一定发生氧化还原反应;
C.若发生2C﹣+B2=2B﹣+C2,还原性为C﹣>B﹣;
D.①中Cu元素的化合价降低,②中Fe元素的化合价降低,结合氧化剂的氧化性大于氧化产物的氧化性分析.
解答: 解:A.HClO4中氯元素化合价比HClO中氯元素化合价高,HClO4的酸性强,不能以此比较氧化性,而氧化性HClO强,故A错误;
B.强氧化性和强还原性的物质不一定发生氧化还原反应,如浓硫酸和CO、氢气等不反应,故B错误;
C.若发生2C﹣+B2=2B﹣+C2,还原性为C﹣>B﹣,与已知还原性矛盾,故C错误;
D.①中Cu元素的化合价降低,②中Fe元素的化合价降低,由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性强弱顺序为Fe3 +>Cu2+>Fe2+,故D正确;
+>Cu2+>Fe2+,故D正确;
故选D.
点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和规律性知识的考查,注意利用实例分析,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
(4)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某燃煤发电厂处理废气的装置示意图.下列说法错误的是()

A. 使用此废气处理装置可减少酸雨的形成
B. 装置内发生的反应有化合、分解、置换和氧化还原反应
C. 整个过程的反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2
D. 若烟囱的气体排放不达标,则此气体可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用如图中的装置可以实现该反应.
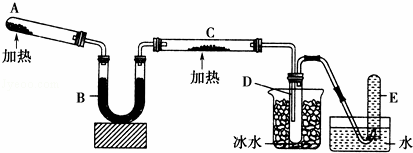
回答下列问题:
(1)A中发生反应的化学方程式是 .
(2)B中加入的干燥剂是(填序号)③①浓硫酸 ②无水氯化钙 ③碱石灰
(3)能证明氨与氧化铜反应的现象是①C中 ,②D中有无色液体生成设计实验检验D中无色液体的成分:取少量 粉末,现象为 .
(4)写出氨气与氧化铜反应化学方程式 若收集到2.24L(STP)氮气,计算转移电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中能大量共存的一组离子或分子是()
A. NH4+、H+、NO3﹣、HCO3﹣ B. K+、Al3+、SO42﹣、NH3•H2O
C. Na+、K+、SO32﹣、Cl2 D. Na+、CH3COO﹣、CO32﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
CuO和Fe2O3的混合物m g,向其中加入1mol•L﹣1的HNO3溶液200mL恰好完全反应,若将2m g该混合物用足量CO还原,充分反应后剩余固体质量为()
A. 3.2 g B. (2m﹣3.2)g C. (m﹣1.6)g D. (2m﹣1.6)g
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是提纯大理石(主要杂质是氧化铁)的流程图:
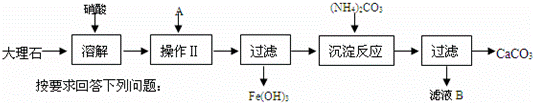
按要求回答下列问题:
(1)在工业生产中,将块状大理石磨成粉末,并在反应池中安装搅拌机.目的是 .
(2)操作Ⅱ中A物质最好应选择 (填化学式),在该过程中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是 .
(3)检验Fe3+已完全生成Fe(OH)3沉淀的方法是 .
(4)由滤液B得到晶体B,操作过程包括 (填操作名称)、冷却结晶.
(5)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下:

①按气流方向连接各仪器接口,顺序为a→d→e→c→b→f.装置C、装置D的作用分别是 .
②实验开始后,能证明二氧化氮支持燃烧的实验现象是 .
③已知二氧化氮和碳反应生成两种物质的量比为1:1有毒气体,则该反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 4H++2Fe2++4SO42﹣;
4H++2Fe2++4SO42﹣;
②4Fe2++O2+4H+ 4Fe3++2H2O;
4Fe3++2H2O;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2
4H++2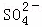 .
.
已知:FeS2中的铁元素为+2价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整.
(2)反应③的还原剂是 .
(3)观察上述反应,FeS2最终转化为 从煤炭中分离出来.
查看答案和解析>>
科目:高中化学 来源: 题型:
图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是()
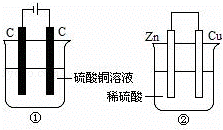
A. 产生气体体积:①=②
B. ①中阴极质量增加,②中正极质量减小
C. 电极反应式:①中阳极:4OH﹣﹣4e﹣=2H2O+O2↑②中负极:2H++2e﹣=H2↑
D. 溶液的pH变化:①减小,②增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com