
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
分析 铜与稀硝酸反应生成硝酸铜一氧化氮和水;先加入与其等体积的稀硫酸,再投入足量的铜粉反应,溶解的铜比第一份要多,因为硫酸提供氢离子和溶液中的硝酸根离子形成硝酸会继续溶解铜,所以分析反应实质,只需根据发生反应的离子方程式继续计算即可:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O.
解答 解:第一份只有HNO3,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,H+不足,溶液中剩余NO3-,设有8molHNO3,
则生成2molNO,消耗8molH+;
另一份先加入与其等体积的稀硫酸,溶液中硫酸提供H+,3V1=V2,则应生成6molNO,根据3Cu+8H++2NO3-=3Cu2++2NO↑+H2O,可知消耗24molH+,原来硝酸溶液中含溶质8mol,硫酸溶液中含氢离子为16mol,硫酸的物质的量为8mol,硝酸和硫酸是等体积混合,稀硝酸与稀硫酸的物质的量浓度之比为1:1;
故选:A.
点评 本题考查了物质的量浓度有个计算,明确硝酸与铜反应的离子方程式是解题关键,注意计算时应依据离子方程式计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 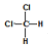 和 和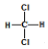 、 、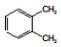 和 和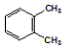 属于同分异构体 属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 | |
| B. | ①中Se是氧化产物,I2是还原产物 | |
| C. | 反应①中KI是氧化剂,SeO2是还原剂 | |
| D. | 反应①中每有1.0mol I2生成,转移电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
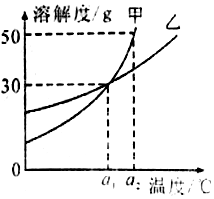
| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水的物质的量为1摩尔 | |
| B. | 常温常压下,32g O3气体物质的量为1摩尔 | |
| C. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| D. | 2.24L CO2中含有的原子数为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L乙烷分子中的碳原子数目为2NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
| Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中SO3的浓度小于0.022 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中SO3的浓度大于0.044 mol•L-1 | |
| D. | 若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,则反应向逆反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com