

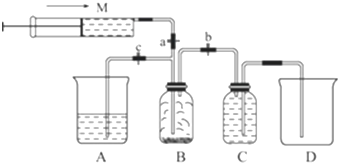
分析 (1)氯气有毒,做实验室应注意通风、尾气处理,上风区氯气的含量很低,比较安全,可脱离氯气的污染区,因此要逆风疏散,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(2)①氯气能够与碱反应,具有氧化性,能够与还原性物质发生反应据此解答;
②氯气与亚硫酸钠反应生成硫酸钠和氯化氢;
(3)①次氯酸钠具有强的氧化性,能够氧化铁生成三价铁离子;
②消毒液有效成分是次氯酸盐与二氧化碳和水生成的次氯酸,次氯酸不稳定,见光分解;
③次氯酸根离子与氯离子发生氧化还原反应生成氯气和水;
(4)氯气与碘离子发生氧化还原反应,离子方程式:Cl2+2I-=I2+2Cl-,消耗100mL0.001mol•L-1KI溶液,同时消耗氯气的质量$\frac{0.001×0.001}{2}$×71×103mg,判断是否超标,还需要知道通入空气的体积,因为空气中氯气的含量超过0.1 mg/m3就会引起中毒.
解答 解:(1)氯气有毒,做氯气实验时,要注意通风,要防止中毒,填写“通风”;上风区氯气的含量很低,比较安全,可脱离氯气的污染区,因此要逆风疏散;Cl2和碱液能发生反应,氯气的尾气常常用碱液吸收,Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:通风;逆风;Cl2+2OH-=Cl-+ClO-+H2O;
(2)①氯气能够与碱反应,具有氧化性,能够与还原性物质发生反应,可以用碱性物质或者还原性物质吸收,
a、氯化钠溶液不与氯气反应,故a错误;
b、氯气与能够与硫酸铁反应,故b错误;
c、SO32-具有还原性,能够与氯气反应,可以吸收氯气,故c正确;
故选:c;
②氯气与亚硫酸钠溶液反应的离子方程式:H2O+SO32-+Cl2=SO42-+2Cl-+2H+,
故答案为:H2O+SO32-+Cl2=SO42-+2Cl-+2H+;
(3)①NaClO具有漂白作用,利用了NaClO的氧化性,而金属具有还原性,发生了氧化还原反应,对金属腐蚀,
故答案为:NaClO有强氧化性,而一般金属具有较强还原性;
②消毒液有效成分是次氯酸盐与二氧化碳和水生成的次氯酸,次氯酸不稳定,见光分解,所以应该密封保存;
故答案为:消毒液的有效成分NaClO能与空气中的CO2作用,使其变质;
③次氯酸根离子与氯离子发生氧化还原反应生成氯气和水,离子方程式:Cl-+ClO-+2H+=Cl2↑+H2O;
故答案为:Cl-+ClO-+2H+=Cl2↑+H2O;
(4)氯气与碘离子发生氧化还原反应,离子方程式:Cl2+2I-=I2+2Cl-,消耗100mL0.001mol•L-1KI溶液,同时消耗氯气的质量$\frac{0.001×0.001}{2}$×71×103mg,判断是否超标,还需要知道通入空气的体积,因为空气中氯气的含量超过0.1 mg/m3就会引起中毒;
故答案为:通入空气的体积.
点评 本题考查了氯气的性质和有关氧化还原反应、离子方程式的书写,题目难度中等,熟悉物质性质和相关规律是解题关键.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: | |
| B. | ${\;}_{1}^{1}{H}_{2}$、${\;}_{1}^{2}$H2、${\;}_{1}^{3}{H}_{2}$是氢的三种同位素 | |
| C. | 原子核内有10个中子的氧原子${\;}_{8}^{18}O$ | |
| D. | 金刚石、石墨、甲烷属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 迄今有机化合物种类已达几千万种,远远高于无机物,但碳在地壳中含量却不是很高 | |
| B. | 有机物种类繁多的一个重要原因是同系物现象的存在 | |
| C. | 有机物与我们生活息息相关,石油、甘油、豆油;清洁剂、粘合剂、干燥剂;人造纤维、合成纤维、光导纤维都是有机物 | |
| D. | 组成有机物的元素除碳外还有氢、氧、氮、硫、卤素、磷等,NH4OCN CCl4 CS2都是有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在KI溶液中存在下列平衡:T2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
在KI溶液中存在下列平衡:T2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A. | 反应I2(aq)=I-(aq)?I${\;}_{3}^{-}$(aq)△H>0 c(I3-)/mol•L-1 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1 | |
| C. | 若T1时,反应进行到状态d时,一定有υ正>υ逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计出如图装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如图装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com