
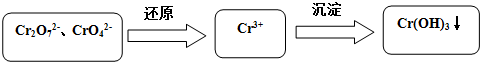
分析 (1)根据化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-})×{c}^{2}({H}^{+})}$进行计算;
(2)二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原为Cr3+,自身被氧化为SO42-;根据Ksp[Cr(OH)3]=c(Cr3+)•c3(OH-)=10-32计算c(OH-),从而计算pH;
(3)利用电解产生的Fe2+将Cr2O72-还原为Cr3+,则Fe为阳极生成Fe2+;
(4)Cr(OH)3与Al(OH)3性质类似,Cr(OH)3与稀硫酸反应生成硫酸铬和水.
解答 解::(1)若常温下pH=1溶液中Cr2O72-浓度为0.1mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍即CrO42-浓度为0.01mol•L-1,化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-})×{c}^{2}({H}^{+})}$=$\frac{0.1}{0.0{1}^{2}×0.{1}^{2}}$=1.0×105,
故答案为:1.0×105;
(2)二氧化硫具有还原性,在酸性溶液中通SO2将Cr2O72-还原为Cr3+,自身被氧化为SO42-,反应离子方程式为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O,
Ksp[Cr(OH)3]=c(Cr3+)•c3(OH-)=10-32,则c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol•L-1,则溶液中c(H+)=10-5mol•L-1,溶液pH=-lg10-5=5,
故答案为:3SO2+Cr2O72-+2H+=2Cr3++3SO42-+H2O;5;
(3)利用电解产生的Fe2+将Cr2O72-还原为Cr3+,则Fe为阳极生成Fe2+,Fe连接直流电源的正极,
故答案为:正;
(4)Cr(OH)3与Al(OH)3性质类似,Cr(OH)3与稀硫酸反应生成硫酸铬和水,反应方程式为:2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O,
故答案为:2Cr(OH)3+3H2SO4=2Cr2(SO4)3+6H2O.
点评 本题考查平衡常数计算、溶度积有关计算、电解原理、氧化还原反应、元素化合物性质等,侧重考查学生对基础知识的迁移应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶的支管口处 | |
| D. | 分液操作时,首先要打开分液漏斗的上口瓶塞,或使瓶塞上的凹槽与上口部的小孔对准,然后进行分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 孤电子对与成键电子对间的斥力大于成键电子对间的斥力 | |
| B. | 孤电子对与成键电子对间的斥力小于成键电子对间的斥力 | |
| C. | 孤电子对与成键电子对间的斥力等于成键电子对与成键电子对间的斥力 | |
| D. | 题干中的数据不能说明孤电子对与成键电子对间的斥力与成键电子对与成键电子对间的斥力之间的大小关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | 充入稀有气体增大体系压强,可提高该反应的反应速率 | |
| C. | 平衡时A与B的转化率相等,均为40% | |
| D. | 平衡时B与C的浓度之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的熔、沸点低 | |
| B. | 钠的颜色是银白色的 | |
| C. | 钠与空气中氧气反应,条件不同产物不同 | |
| D. | 因为反应要加热,所以该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
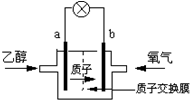 美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | a极为电池的负极 | |
| B. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-═H2O | |
| D. | 电池工作时1mol乙醇被氧化时就有6mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com