
����Ŀ�����ڵؿ��еĺ������࣬��Ҫ��������þ����ɰ�ȸ������С��ش��������⣺
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ_______����Ԫ�ص�ij��ͬ��������B12���۵�λ2180�棬�ݴ��Ʋ�B12�����ۻ�ʱ�ƻ���������Ϊ__________��
��2��������ͬ����������Ԫ�صĵ�һ�������ɴ�С��˳����__________��
��3����ԭ�������ֻ���������ӣ�����縺�Խϴ�ԭ����_________��
��4��������(H3BO3)�ǰ�ɫ���壬�侧����������ζԳ�Ƭ״����ṹ����ͼ��ʾ��
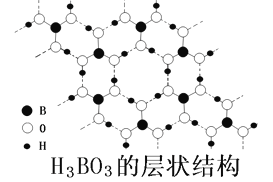
������������е�Bԭ�Ӳ�ȡ__________�ӻ���1molH3BO3ƽ���γ�________mol�����
����������۵�ԶԶ�����������[B(OCH3)3]��ԭ����________��
��5��д����BF3��Ϊ�ȵ������2��������_________���ѧʽ����
��6����ͼΪ�����������ṹʾ��ͼ������Nԭ�ӵ���λ��Ϊ____����Nԭ�Ӱ뾶Ϊa pm��Bԭ�Ӱ뾶Ϊb pm������٤������ֵΪNA������������������ܶ�Ϊ________g/cm3����ʽ���ɣ���

���𰸡� 1s22s22p1 ���ۼ����Ǽ��Լ��������Ǽ��Թ��ۼ����������»��� C>Be>B B��ԭ�Ӱ뾶��С����������˵����ɣ� sp2 3 ��������Ӽ����γɷ��Ӽ�����������۵�ϸ� NO3-��CO32-��SiO32-��BO33-�� 4 
����������1����̬��ԭ�ӵĺ����������5����������Ų�ʽΪ1s22s22p1����Ԫ�ص�ij��ͬ��������B12���۵�Ϊ2180�棬�۵�ߣ��ݴ��Ʋ�B12�����ۻ�ʱ�ƻ���������Ϊ���ۼ�����2��ͬ�����������ҵ�һ������������Be��2s�������ȫ����״̬�ȶ���ǿ����������ͬ����������Ԫ�صĵ�һ�������ɴ�С��˳����C>Be>B����3����ԭ�������ֻ���������ӣ���B��ԭ�Ӱ뾶��С�������縺�Խϴ�4����Bֻ�γ���3��������û�йµ��Ӷԣ����Բ�ȡsp2�ӻ���1����������γ���6���������ÿ�������2��������ӹ��õģ�����ƽ����3���������1molH3BO3ƽ���γ�3mol�������������������Ӽ����γɷ��Ӽ�����������۵�ϸߡ���5��ԭ�����ͼ۵������ֱ���ȵĻ�Ϊ�ȵ����壬����BF3��Ϊ�ȵ������������NO3-��CO32-��SiO32-��BO33-�ȡ���6�����ݾ����ṹ���ж�Nԭ�ӵ���λ��Ϊ4����Nԭ�Ӱ뾶Ϊa pm��Bԭ�Ӱ뾶Ϊb pm�������������Խ�����4(a+b)pm=4(a+b)��10��10cm���߳���![]() ��������Nԭ����ĿΪ4��Bԭ����ĿΪ8��1/8+6��1/2=4����������Ϊ4��25/NAg�����Ծ����ܶ�=
��������Nԭ����ĿΪ4��Bԭ����ĿΪ8��1/8+6��1/2=4����������Ϊ4��25/NAg�����Ծ����ܶ�=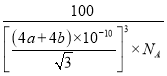 g/cm3��
g/cm3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ����٤������������˵����ȷ���ǣ�������
A.16g�����ͳ����Ļ�����к��е���ԭ����ΪNA
B.��״���£�22.4 Lˮ�к��е���ԭ����ΪNA
C.NA���������ӵ����Ϊ22.4L
D.���ʵ���Ũ��Ϊ0.5 mol/L��MgCl2��Һ�У����е�Cl������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ������NaCl��MgCl2��AlCl3������Һ�У��ֱ���������AgNO3��Һ��ǡ�ö���ȫ��Ӧ��������������Һ�����ʵ���Ũ��֮��Ϊ��������
A.1��2��3
B.3��2��1
C.1��1��1
D.6��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ��A�Ǻ�ɫ�ǽ������ʣ�C��E��F��Ϊ�����E��F�����³���̬����E��ʹƷ����ɫ��G��һ�ֳ�������ɫҺ�壬I��һ��������ˮ�İ�ɫ��״������������B��Һ����ش��������⣺

(1) C�Ļ�ѧʽΪ________��
(2)G�ĵ���ʽΪ________��
(3)д������Ӧ�Ļ�ѧ����ʽ��_______________________________________________��
(4)д��������F�μӷ�Ӧʱ�������ӷ���ʽ��_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��������߳��ĵ����þƬ������̿Ϊ�缫�����ϵμ�ʳ��ˮ���ر�ɹ�������ط�ӦΪ2Mg+O2+2H2O = 2Mg (OH)2 �����й��ڸõ�ص�˵����������( )

A. ʳ��ˮ��Ϊ�������Һ
B. ��ع���ʱþƬ��Ϊ����������
C. ��ع���ʱʵ���˻�ѧ������ܵ�ת��
D. ����̿�缫�ϵķ�ӦΪO2+2H2O + 4e�� = 4OH -
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ��X��Y�߾���Z����������AΪ��Ҫԭ�ϣ���������·�ߺϳɡ�
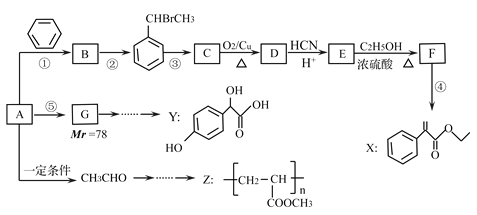
��֪����.��Ӧ�١���Ӧ�ڵ�ԭ�������ʾ�Ϊ100%.
��. ��R��R��������������ԭ�ӣ�
��R��R��������������ԭ�ӣ�
��ش��������⣺
(1)A�Ľṹ��ʽΪ____________��
(2)Z�еĹ���������Ϊ__________����Ӧ�۵�����Ϊ___________��
(3)����ҩ��Y��![]() ����˵����ȷ����______________��
����˵����ȷ����______________��
A.1molҩ��Y���������Ʒ�Ӧ��������33.6L������
B.ҩ��Y�ķ���ʽΪC8H8O4����ʹ���Ը��������Һ��ɫ
C.ҩ��Y�Тޡ��ߡ�������-OH��������ǿ������˳���Ǣ�>��>��
D.1molҩ��Y��H2��Ũ��ˮ�е�Br2��Ӧ���������H2��Br2�ֱ�Ϊ4mol��2mol
(4)д����ӦE��F�Ļ�ѧ����ʽ_________________��F��X�Ļ�ѧ����ʽ______________________��
(5)д����������������E��һ��ͬ���칹��Ľṹ��ʽ____________��
����FeCl3��Һ���Է�����ɫ��Ӧ�����DZ��Ķ�λ��Ԫȡ������ܷ���������Ӧ��ˮ�ⷴӦ���ۺ˴Ź���������6���塣
(6)�ο�����������CH3CHO��CH3OHΪ��ʼԭ�ϣ��������Լ���ѡ����ƺϳ�Z����·��_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeO��Fe2O3��Fe3O4��ɵĻ���������������Ԫ������Ԫ�ص�������Ϊ21��8�������ֻ������FeO��Fe2O3��Fe3O4�����ʵ���֮����
A��1��2��1 B��2��1��1
C��1��3��1 D��1��1��3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com