
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
A. Na+、Fe3+、NO3-、C12都可在该物质的溶液中大量共存
B. 向0. 1 mol/L该物质的溶液中逐滴滴加0. 1mol/L NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
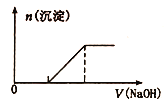
C. 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入儿滴KSCN溶液,观察溶液是否变红色
D. 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为 Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
【答案】C
【解析】试题分析:A.Fe2+ 有还原性,可被Cl2氧化为Fe3+而不能大量共存,错误;B.滴加NaOH溶液,首先是Fe2+ 先与OH反应生成白色沉淀,然后是发生反应:NH4++OH-=NH3H2O,图像与发生的反应事实不符合,错误;C.若Fe2+ 被氧化为变质为Fe3+,只需滴入几滴KSCN溶液,可观察到溶液变为红色,因此可鉴别,正确;D. 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为Fe2++ 2NH4++ 2SO42-+ 2Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2 NH3H2O,,漏掉NH4+与OH-的反应,故错误。


科目:高中化学 来源: 题型:
【题目】可逆反应3A(g)+2B(g)![]() 4 C(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是
4 C(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是
A. 3v正(A)=2v正(B) B. 2v正(A)=3v逆(B) C. 4v逆(C)=3v正(A) D. 3v逆(A)=2v逆(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 用排水法收集铜粉与浓硝酸反应产生的NO2
B. 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液
C. 用酸性KMnO4溶液验证草酸的还原性
D. 用饱和NaHCO3溶液除去Cl2中混有的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从经济效益和环境保护的角度考虑,大量制取硝酸铜最宜采用的方法是( )
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu ![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
D.Cu ![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某生物小组进行无土栽培实验,观察不同矿质元素对南瓜植株生长发育的影响。在4组单因素缺素培养实验中,他们观察到其中一组的表现为老叶形态、颜色正常,但幼叶颜色异常,呈黄白色。该组缺乏的元素是
A.K B.P C.Mg D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
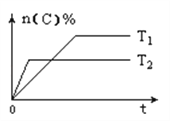
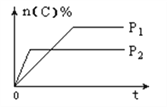
A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去)。
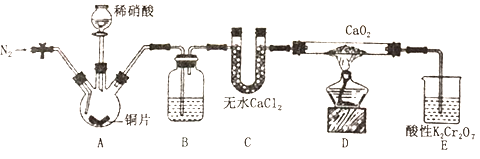
已知:2NO+CaO2=Ca(NO2)2;2NO2+CaO2 =Ca(NO3)2。
请回答下列问题:
a.向装置中通入N2;b.向三颈烧瓶中滴加稀硝酸;c.点燃酒精灯;d.熄灭酒精灯;e.停止通入氮气;f.关闭分液漏斗旋塞
(1)上述操作的正确排序为_________________________。
(2) B中盛放的试剂是_____,作用是除去________(填化学式)。
(3)装置E中,酸性K2Cr2O7溶液的作用:可剩余的NO氧化成NO3-,溶液由橙色变为绿色(Cr3+),反应的离子方程式是____________。
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体。设计实验证明D中有亚硝酸钙生成_____________。
(5)整个过程持续通人氮气的作用_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com