
(18分)下表为长式周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出元素D与A形成的化合物的电子式 ,该化合物分子的空间构型是 ,其中元素D的杂化方式为 。
(2)J的离子结构示意图 ;K元素在周期表的位置 。元素L基态原子的电子排布式 。
(3)E、H、I 这三种元素的第一电离能由大到小的顺序是(填对应的元素符号) ;
(4)由D、J的氢化物相互作用所生成的物质所含化学键有下列的 。
A、离子键
B、非极性键
C、极性键
D、金属键
E、配位键
(5)用氢键表示式写出F的氢化物水溶液中所有氢键
(1)电子式略 (2分) 三角锥型(2分)。sp3 (1分) (2)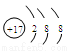 (1分)
(1分)
第四周期第Ⅷ族 ;(2分)[Ar]3d104s1; (2分)(3)O>Mg> Al(2分)(4)ACE(2分)(5)F—H...F 、 F—H...O 、 O—H...F 、 O—H...O (4分)
【解析】
试题分析:(1)从表中知道A是H,D是N ,形成化合物电子式为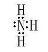
氨分子的空间结构是三角锥形,N 轨道中p的3个电子与3个H进行杂化,杂化方式为sp3
(2)J为Cl,那么离子结构示意图为: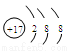 周期表第四周期从左到右族序数依次是ⅠA、ⅡA
周期表第四周期从左到右族序数依次是ⅠA、ⅡA
、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB…… 所 以K是在第Ⅷ族,L是29号元素基态原子的电子排布式可写成[Ar]3d104s1(3)E、H、I分别为O、Mg、Al,元素金属性越强第一电离能越小,所以第一电离能大小为: O>Mg> Al(4)由D、J的氢化物相互作用所生成的物质是NH4Cl,是离子化合物则有离子键,N和H可形成极性键和配位键,所以化学键种类为离子键、极性键、配位键。
(5)F的氢化物则是HF,水溶液中氢键有F—H...F 、 F—H...O 、 O—H...F 、 O—H...O
考点:元素周期表的结构、原子、离子结构示意图的书写、电离能大小比较以及化学键的类型。


科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:计算题
(7分)已知25℃时KW=1.0×10-14 试计算:
(1)计算室温条件下0.1mol/LHCl溶液中由水电离的氢离子浓度.
(2)计算室温条件下0.01mol/LNaOH溶液的pH.
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:选择题
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:由上述现象可推知a、b、c、d依次是
反应物 | a+b | c+d | a+d | a+c | b+d |
现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
A.HCl、BaCl2、AgNO3、Na2CO3
B.AgNO3、HCl、BaCl2、Na2CO3
C.AgNO3、HCl、Na2CO3、BaCl2
D.BaCl2、Na2CO3、 AgNO3、HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:选择题
下列各组内物质的转化,只通过一步反应不能完成的是
A.Zn→H2 B.CaO→CaSO4
C.CO2→CaCO3 D.Cu→Cu(OH)2
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:
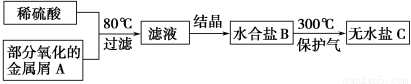
将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是
A.过滤所得的残渣中一定没有金属A
B.滤液可能是CuSO4溶液或MgSO4溶液
C.水合盐B可能是FeSO4·7H2O
D.无水盐C可能是Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
有下列物质:①白磷;②金刚石;③石墨;④二氧化硅;⑤甲烷;⑥四氯化碳;⑦单质硅;⑧铵根离子。其分子结构或晶体结构单元中存在正四面体的是
A.除③外 B.①②⑤⑥ C.除③⑧外 D.除③④⑦⑧
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
第3周期元素形成的单质中,属于原子晶体的是
A.单晶硅 B.金刚石 C.金刚砂 D.二氧化碳
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
A.K+、OH-、CO32- B.Cu2+、H+、Cl-
C.K+、H+、Cl- D.CO32-、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
A.H2、I2、HI的分子数之比为1∶1∶2
B.混合气体的颜色不再发生变化
C.单位时间生成n mol H2,同时消耗成2n mol HI
D.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com