
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
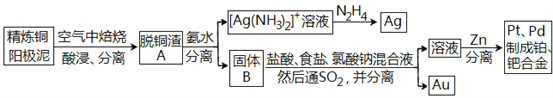
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和_______。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为________________。
(3)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为______,该反应的离子方程式为____________________。
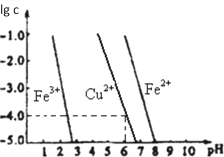
(5)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合如图分析:(其中的纵坐标代表金属阳离子浓度的对数)
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是_______________,然后加入适量的CuO调节pH=3.7,除去______离子;
②从图中数据计算可得Cu(OH)2的Ksp约为_______________。
【答案】 烧杯、漏斗 AgCl + 2NH3·H2O![]() [Ag (NH3)2]+ + Cl- + 2H2O 8 +3价 2Au + ClO3- + 7 Cl- +6H+
[Ag (NH3)2]+ + Cl- + 2H2O 8 +3价 2Au + ClO3- + 7 Cl- +6H+ ![]() 2 AuCl4- + 3H2O 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
2 AuCl4- + 3H2O 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
【解析】(1)各步生产流程中都涉及了同一种分离方法将固体和溶液分开,是过滤操作,该方法需要的玻璃仪器有玻璃棒和烧杯、漏斗;(2)脱铜渣A中含有AgCl,它溶于浓氨水生成络合离子的离子方程式为:AgCl + 2NH3·H2O![]() [Ag (NH3)2]+ + Cl- + 2H2O;(3)根据化学反应N2H4+4Ag(NH3)2OH+=N2↑+4Ag↓+4H2O+8NH3↑可知,每生成1molAg,需要消耗
[Ag (NH3)2]+ + Cl- + 2H2O;(3)根据化学反应N2H4+4Ag(NH3)2OH+=N2↑+4Ag↓+4H2O+8NH3↑可知,每生成1molAg,需要消耗![]() N2H4;(4)设在NaAuCl4中Au元素的化合价为x,则+1+x+(-1)×4=0,解得x=+3, Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4的离子方程式为:2Au + ClO3- + 7 Cl- +6H+
N2H4;(4)设在NaAuCl4中Au元素的化合价为x,则+1+x+(-1)×4=0,解得x=+3, Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4的离子方程式为:2Au + ClO3- + 7 Cl- +6H+ ![]() 2 AuCl4- + 3H2O;(5)①要从浸出液中提纯铜,最好先加入酸化的双氧水,将Fe2+氧化为Fe3+;然后加入适量的CuO调节pH=3.7, Fe3+离子转化为沉淀而除去;②由图中可知,当PH=6时,lgc(Cu2+)=-4,则c(OH-)=10-8mol/L,c(Cu2+)=10-4mol/L,故Ksp Cu(OH)2= c(Cu2+)c2(OH-)=10-4mol/L×(10-8mol/L)2=10-20mol3/L3。
2 AuCl4- + 3H2O;(5)①要从浸出液中提纯铜,最好先加入酸化的双氧水,将Fe2+氧化为Fe3+;然后加入适量的CuO调节pH=3.7, Fe3+离子转化为沉淀而除去;②由图中可知,当PH=6时,lgc(Cu2+)=-4,则c(OH-)=10-8mol/L,c(Cu2+)=10-4mol/L,故Ksp Cu(OH)2= c(Cu2+)c2(OH-)=10-4mol/L×(10-8mol/L)2=10-20mol3/L3。


科目:高中化学 来源: 题型:
【题目】关于苯的说法不正确的是( )
A. 苯可以发生取代反应
B. 苯中各原子均在同一平面
C. 苯中没有典型的碳碳双键,所以不能发生加成反应
D. 苯中的含碳量高,燃烧时产生大量的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今世界各国普遍关注的重要问题之一是环境保护,我国政府也相应地采取了一些措施,你认为下列做法与政府措施相符合的是( )。
①净化工业“三废”
②大量植树造林,禁止乱砍滥伐
③减少使用煤、石油等燃料,更好地利用太阳能、风能、地热等
④为提高农作物产量,提倡农民大量施用化肥
A.①②③④
B.①②③
C.②③④
D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大威胁,下列污染现象中主要与排放SO2有关的是 ( )
A. 臭氧空洞 B. 白色污染 C. 温室效应 D. 酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制烧碱的技术是用离子交换膜法,主要原料是饱和食盐水.图为离子交换膜法电解原理示意图:
请回答下列问题: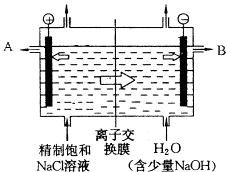
(1)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,这种阳离子交换膜,只允许溶液中的通过(填写下列微粒的编号).
①H2 , ②Cl2 , ③Cl﹣ , ④H+ , ⑤Na+ , ⑥OH﹣ .
(2)B极为电解槽的极,电极反应式为 .
(3)若用碱性氢氧燃料电池给予上述电解槽供电,燃料电池的正极反应式为:; 如果每小时能产生标准状况下的氯气V L,则每小时至少向燃料电池中输入氧气的物质的量(理论计算)mol.
(4)若将标准状况下13.44L的阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,得到了两种含氯化合物,其中还原产物与氧化产物物质的量之比为5:1,写出该反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相等的是( )
A.10g H2和10g O2
B.5.6g N2 (标准状况)和 11g CO2
C.9g H2O 和0.5mol Br2
D.224mL H2(标准状况)和0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
A. | 取20.0 mL盐酸 | 用50ml量筒量取,读数时仰视刻度线 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述放热反应,X(g)+Y(g)![]() 2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
![]()
A. 反应速率:v(B)>v(A) B. A容器中X的转化率为80%
C. 平衡时的压强:PB>2PA D. 平衡时Y体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 2.2 g D218O中含中子数为NA
B. 22.4 L( 标准状况)乙醇含-OH数目为NA
C. 向1L pH=3的醋酸中加入足量氨水,生成CH3COO-数目为1×10-3NA
D. 反应Cl2 +2NaClO2=2ClO2 +2NaCl,每生成1mol ClO2转移电于数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com