
分析 (1)加入次氯酸钾、酸性介质,氯酸根离子具有氧化性,亚铁离子具有还原性,亚铁离子被氧化;
(2)实验室进行“蒸发”时用到的仪器有铁架台(带铁圈)、酒精灯和蒸发皿、玻璃棒;
(3)SPFS溶于水后并与水反应生成氢氧化铁胶体能吸附水中的悬浮物来净化水;
(4)根据Fe元素守恒计算n(Fe3+)=2n(Fe2O3),白色沉淀20.97g为BaSO4,而n(SO42-)=n(BaSO4),再根据电荷守恒计算n(OH-),再根据盐基度定义式计算;
(5)由聚合硫酸铁的质量,结合(4)各离子物质的量计算n(H2O),计算n(Fe3+):n(OH-):n(SO42-):n(H2O)比例关系确定化学式.
解答 解:(1)在绿矾中加入酸性介质的NaClO3目的是:将Fe2+氧化为Fe3+,
故答案为:将Fe2+氧化为Fe3+;
(2)实验室进行“蒸发”时用到的仪器有铁架台(带铁圈)、酒精灯和蒸发皿、玻璃棒,
故答案为:蒸发皿、玻璃棒;
(3)SPFS溶于水后并与水反应生成氢氧化铁胶体能吸附水中的悬浮物来净化水,
故答案为:氢氧化铁胶体;
(4)根据Fe元素守恒:n(Fe3+)=2n(Fe2O3)=$\frac{5.6g}{160g/mol}$×2=0.07 mol,
白色沉淀20.97g为BaSO4,n(SO42-)=n(BaSO4)=$\frac{20.97g}{233g/mol}$=0.09mol,
根据电荷守恒:n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.07mol-2×0.09mol=0.03mol,
则盐基度=$\frac{0.03mol}{0.07mol×3}$×100%=14.29%,
故答案为:14.29%;
(5)n(Fe3+)=0.07 mol,m(Fe3+)=0.07mol×56g/mol=3.92g
n(SO42-)=0.09mol,m(SO42-)=0.09mol×96g/mol=8.64g,
n(OH-)=0.03mol,m(OH-)=0.03mol×17g/mol=0.51g,
m(H2O)=15.05g-3.92g-8.64g-0.51g=1.98g,则n(H2O)=$\frac{1.98g}{18g/mol}$=0.11mol
n(Fe3+):n(OH-):n(SO42-):n(H2O)=0.07:0.03:0.09:0.11=7:3:9:11,
故该固体聚合硫酸铁样品的化学式为:Fe7(OH)3(SO4)9•11H2O,
故答案为:Fe7(OH)3(SO4)9•11H2O.
点评 本题考查物质制备实验,涉及物质的性质、胶体的性质及化学计算等问题,题目难度中等,做题时注意分析题中关键信息、明确实验流程中的反应、物质的量关系等为解答的关键,充分考查了学生的分析、化学实验、化学计算能力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | HCl | C. | NaOH | D. | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ②④⑥ | C. | ①③⑤ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、Cu2+、NO3-、OH- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | Fe3+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 反应前后有元素化合价变化的反应一定是氧化还原反应 | |
| D. | 金属阳离子被还原一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯丙醇胺的结构简式为: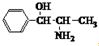 ,其分子中有2个手性碳原子 ,其分子中有2个手性碳原子 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 完全由非金属元素形成的化合物中也可能含有离子键 | |
| D. | CO2、SiO2都是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com