
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
分析 (1)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大;
(2)碳酸钠和碳酸氢钠促进水的电离,水解程度大,则水的电离程度大;Na2CO3溶液中CO32-的水解大于碳酸氢钠中HCO3-的水解,据此进行判断;
(3)碳酸氢钠属于盐类,在水溶液里完全电离生成钠离子和碳酸氢根离子;碳酸氢根离子水解生成碳酸分子和氢氧根离子;0.1mol•L-1NaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度大于电离程度;
(4)①根据盐类的水解和电荷守恒来分析,注意盐类的水解是微弱的;
②开始沉淀时pH小的离子先沉淀,溶度积常数越小的物质越先沉淀;0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,根据Ksp计算pH.
解答 解:(1)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故选C,
故答案为:CO32-;C;
(2)碳酸钠和碳酸氢钠促进水的电离,碳酸根离子水解程度大,则碳酸钠中水的电离程度大,即溶液中水电离出的H+个数:②>①,Na2CO3溶液中CO32-的水解大于乙中HCO3-的水解,则碳酸钠中阴离子浓度之和大,即溶液中阴离子的物质的量浓度之和:②>①,
故答案为:<;:②>①;
(3)碳酸氢钠属于盐类,在水溶液里完全电离生成钠离子和碳酸氢根离子,属于强电解质,HCO3-水解生成碳酸分子与氢氧根离子,水解离子方程式为:HCO3-+H2O?H2CO3+OH-,常温下,0.1mol•L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),
故答案为:强;HCO3-+H2O?H2CO3+OH-;c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
(4)①300mL 1mol•L-1的NaOH的物质的量=1mol/L×0.3L=0.3mol,标准状况下4.48LCO2的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,所以氢氧化钠和二氧化碳反应方程式为2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根离子水解而使溶液呈碱性,即c(OH-)>c(H+),碳酸根离子水解生成碳酸氢根离子,所以c(HCO3-)>c(CO32-),由于水解程度较小,所以c(CO32-)>c(OH-),故溶液中各离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
②pH小的离子先沉淀,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,KSP[(Fe(OH)2]<KSP[(Mg(OH)2],0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,c(0H-)=$\sqrt{\frac{2×1{0}^{-20}}{2×1{0}^{-4}}}$=10-8mol/L,c(H+)=10-6mol/L,所以pH=6,
故答案为:Cu2+;<;6.
点评 本题考查了弱电解质的电离、盐的水解、离子浓度的比较、Ksp的应用等知识点,题目考查的知识点较多,题目难度中等,注意把握溶液中离子浓度大小比较的方法.


科目:高中化学 来源: 题型:选择题
| A. | 在外加电场的作用下,胶体发生电泳现象,说明胶体是带电荷的 | |
| B. | 水的沸点比硫化氢的沸点高,是因为水分子内形成了氢键 | |
| C. | 晶体中有阴离子就一定有阳离子 | |
| D. | 有单质参加或生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同,组成元素也相同的化合物一定是同分异构体 | |
| B. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定是同分异构体 | |
| D. | 分子式相同的不同有机物一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、Fe2+、Ba2+ | B. | OH-、NO3-、Ba2+、Cl- | ||
| C. | H+、CO32-、Mg2+、Ba2+ | D. | OH-、NO3-、CO32-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Cl-、AlO2- | B. | SO42-、NO3-、Fe2+、Al3+ | ||
| C. | Cl-、SO32-、Na+、K+ | D. | Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
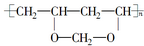 ,它是由聚乙烯醇
,它是由聚乙烯醇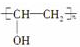 与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )
与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )| A. | CH3OH | B. | HCHO | C. | HO-CH2CH2-OH | D. | HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 四种元素中原子半径最大的为Z | |
| B. | Y、Z、M的氢化物中,M的氢化物最稳定 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物不能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com