
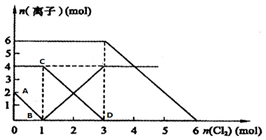
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.分析 (1)氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性;
(2)A→B代表碘离子,而C→D代表亚铁离子浓度的变化;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol;
(4)依据(3)分析计算,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,计算得到两种物质的量之比;
(5)氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;
解答 解:(1)反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-;
故答案为:I->Fe2+>Br-;
(2)A→B代表碘离子,而C→D代表亚铁离子浓度的变化,故答案为:Fe2+;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol;所以当通入1mol Cl2时,溶液中已发生的离子反应可表示为:Cl2+2I-=2Cl-+I2,故答案为:Cl2+2I-=2Cl-+I2;
(4)碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3;
故答案为:2:1:3;
(5)当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-;
故答案为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-.
点评 本题考查学生氧化还原反应中氧化性和还原性强弱的知识,综合性较强,难度较大.


科目:高中化学 来源: 题型:实验题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2 | B. | NaOH | C. | BaCl2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3 | B. | NaOH | C. | H2SO4 | D. | CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吗啡 | B. | 可卡因 | C. | 甘油 | D. | 海洛因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镁、铝、铁是重要的金属,在工业生产中用途广泛.
镁、铝、铁是重要的金属,在工业生产中用途广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com