
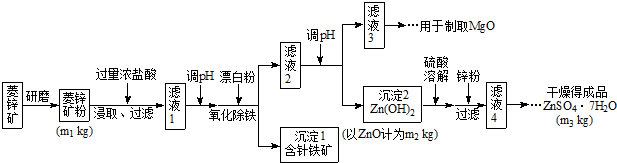
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:

将菱锌矿研磨成粉的目的是_____。
完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的ph时,理论上可选用的最大区间为______。
|
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
24.
(1)增大反应物接触面积或增大反应速率或使反应更充分。
![]()
(3)FeO(OH)(或其他合理答案)
![]()
(5)b或(b和d );d
(6)蒸发浓缩、冷却结晶(或其他合理答案)
(7)125m2/81m;(或其他合理答案)
本题以工业生产硫酸锌的工艺流程为依托,综合考查了化学反应速率、氧化还原反应、沉淀的转化与生成以及化学实验、计算等,学科内综合性强,知识覆盖面大,具有较好的难度梯度。其生产流程及原理理解如下:首先将矿石粉碎以增大反应物之间的接触面积,增大反应速率,溶于过量浓盐酸过滤后得到含Zn2+、Fe2+、Fe3+、Mg2+、Ca2+、H+等的滤液,然后调节pH、加入氧化剂漂白粉使Fe2+、Fe3+等沉淀为针铁矿;此时通过再调节滤液2的pH以仅使Zn2+沉淀,故可根据题中表格所给数据选择pH的范围为:8.0——10.4之间;而所得滤液3中含有较多的Mg2+和Ca2+,利用Mg(OH)2溶解度极小的特点,通过加入石灰石或烧碱溶液调节pH使之沉淀,之后过滤、灼烧沉淀可得MgO;滤液4的溶质仅含硫酸锌,可通过蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作获得结晶硫酸锌。(7)中将m2gZnO“折合”成ZnCO3的质量为:![]() =
=![]() ,加上在流程中损失的锌,故菱锌矿分ZnCO3的质量分数不低于
,加上在流程中损失的锌,故菱锌矿分ZnCO3的质量分数不低于![]() 。
。
【思维拓展】涉及工业生产流程图的试题近年来备受高考命题者的青睐,它可以将化学反应原理的各个知识点有机地融入流程中,还可以接合能源、环保等社会热点问题进行考查。解决此类试题首先要根据所学知识理清流程中的各个步骤,解题是还可以先将试题浏览一遍,有时候问题中可能含有可利用的提示性的信息,或者试题中不涉及的部分流程,就不要去理清这部分,以免做无用功。


科目:高中化学 来源: 题型:
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH[来 | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2. 8×10-9 |
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 125m2 |
| 81m1 |
| 125m2 |
| 81m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
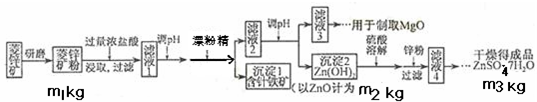
14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是 。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)抽滤装置如下图所示,该装置中的错误之处是___________;抽滤完毕或中途需停止抽滤时,应先_________________________,然后_______________________。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源:2011届上海市长宁区高三下学期教学质量调研试卷(二模)化学试卷 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
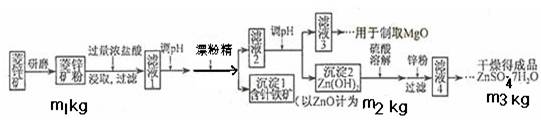
(1)将菱锌矿研磨成粉的目的是____ _,滤液1后两步操作的目是: 。
(2)完成加漂粉精反应的离子方程式:
□Fe(OH)2+□____+□_____ →□Fe(OH)3+□Cl-
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据
, (用文字叙述)
(5) “滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com