
科目:高中化学 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:简答题
以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如右图所示:
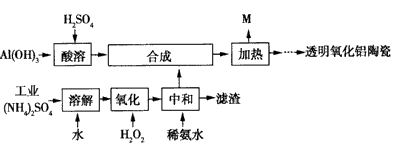
回答下列问题:
(1)氧化步骤中发生的主要反应的离子方程式为________________。
(2)当25℃时,Kw=1.0×10-14,Kb(NH3·H2O)=1.75×105。(NH4)2SO4溶液呈酸性,其原因是(用力方程式解释):__________;该离子方程式的平衡常数K约为______(填具体数字)。
(3)如何检验中和液中的杂质离子已完全除尽_________。
(4)NH4Al(SO4)2溶液与过量NaOH溶液混合加热,反应的化学方程式为__________。
(5)综上分析,流程图中M的主要成分的化学式为________,M可用一种物质吸收以实现循环利用,该物质的名称是_________。
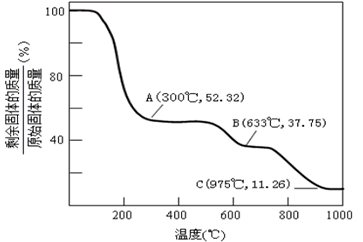
(6)固体NH4Al(SO4)2.12H2O在加热时,固体残留率随温度的变化如图所示。633℃时剩余固体成分的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述中正确的是
A. 标准状况下,11.2 L苯中含有C—H键的数目3NA
B. 常温下,1.0 LpH = 13的Ba(OH)2溶液中含有的OH—数目为0.1NA
C. 常温下,56 g铁片投入足量浓H2SO4中生成NA个SO2分子
D. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
当光束通过下列分散系:①有尘埃的空气 ② 稀硫酸 ③蒸馏水④ 豆浆,能观察到丁达尔效应的是( )
A. ①② B. ②③
C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:简答题
二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C=O | O=O | C—C |
键能(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g) CH3CHO(g)+H2O(g)△H1=____________。
CH3CHO(g)+H2O(g)△H1=____________。
②若2CH3CHO(g)+O2(g) 2CH3COOH(g)反应可自发进行,
2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g) CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
CH3COOH(g)+H2O(g)△H2_____0(填“>”、“<”或“=”)。
(2)将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g) 2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图像不合理的是_________。

(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)= 1.75×10-5,  ≈1.3,lgl.3≈0.1
≈1.3,lgl.3≈0.1
①25℃,0.lmol·L-1CH3COOH 溶液的pH =______;将0.1 mol·L-1CH3COOH溶液与0.1mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为__________________。
②25℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=_____ (保留2位有效数字)。
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
NH4+ + OH-的电离平衡_______(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:填空题
(1)两个试剂瓶各盛装质量相同的浓硫酸和浓硝酸,分别敞口放置一段时间后,两溶液质量关系为m(硫酸)_____ m(硝酸)(填“>”、“<”或“=”),由于浓硫酸和浓硝酸都具有强氧化性,所以冷的浓硫酸和浓硝酸都可以用_____(写金属名称)制容器盛放。
(2)制备CuSO4和Cu(NO3)2
①下列有四种制备Cu(NO3)2的途径,其中最佳途径是(选填字母)___
a. Cu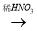 Cu(NO3)2
Cu(NO3)2
b. Cu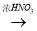 Cu(NO3)2
Cu(NO3)2
c. Cu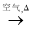 CuO
CuO 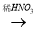 Cu(NO3)2
Cu(NO3)2
d. Cu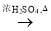 CuSO4
CuSO4  Cu(NO3)2
Cu(NO3)2
② 向稀硫酸溶液中加入铜粉,然后通入热空气,可制得硫酸铜溶液,则发生反应的离子方程式为___________________________________。
(3)向200mL2mol/LHNO3溶液中加入足量铜粉,充分作用后,有m1g固体不溶物,继续 加入100mL 1mol/L硫酸溶液,充分作用后,还有m2g固体不溶物,则 m1 ________ m2(填“>”、“<”或“=”),两者质量相差g_____(若两者相等,则此问不答)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
已知:a、b、c三物质间有如下转化关系a→b→c→a,物质间转化均只需要一步反应便能完成,则a、b、c不可能是( )
A. a:Fe b:FeCl3 c:FeCl2 B. a:AlCl3 b:Al(OH)3 c:Al2O3
C. a:N2 b:NH3 c:NO2 D. a:SO2 b:SO3 c:H2SO4
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:简答题
I.铬单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子轨道表示式为________________;CrO2Cl2常温下为深红色液体,能与CCl4互溶,据此判断CrO2Cl2的晶体类型属于_________________。
(2)配合物CrCl3·6H2O的配位数为6,它有三种不同组成、不同颜色的固体,其中一种为浅绿色固体,该固体与足量硝酸银溶液反应时,0.5mol固体可生成1mol氯化银沉淀,则这种浅绿色固体的配体个数比(Cl-:H2O)为_____________。
II.砷化镓为第三代半导体材料,晶胞结构如图所示:
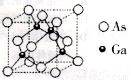
(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为__________。
(4)AsH3分子的立体构型为__________,其中As原子的杂化方式是______。1个(CH3)3Ga分子中含有_________个σ键,砷的第一电离能_______(填“>”或“<”)镓的第一电离能。
(5)砷化镓晶休中砷和镓的最近原子核间距为a nm,砷化镓的摩尔质量为bg·mol-1,阿伏加德罗常数值为NA,则砷化镓晶体的密度表达式是_____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一3月月考化学试卷(解析版) 题型:选择题
下列除杂的操作方法正确的是 ( )
A. N2中有少量的O2:通过灼热的木炭。
B. 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干。
C. NO中有少量的NO2:用水洗涤后再干燥。
D. CO2中混有少量的SO2气体:通过饱和NaHSO3溶液洗气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com