
下列各组中,元素的电负性递增的是( )
|
| A. | Na K Rb | B. | N B Be | C. | O S Se | D. | Na P N |
考点:
元素电离能、电负性的含义及应用.
专题:
化学键与晶体结构.
分析:
一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小;电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在左下角,据此即可解答.
解答:
解:元素周期表中同周期元素从左到右元素的电负性逐渐增强,同主族元素从上到下元素的电负性逐渐减弱,
A.同主族元素从上到下,元素的电负性逐渐变小,则电负性Na>K>Rb,故A不选;
B.同周期主族元素从左到右,元素的电负性逐渐增大,则电负性N>B>Be,故B不选;
C.同主族元素从上到下,元素的电负性逐渐变小,则电负性O>S>Se,故C不选;
D.同周期元素从左到右,元素的电负性逐渐变大,同主族元素从上到下,元素的电负性逐渐变小,则电负性Na<P<N,故D选;
故选:D.
点评:
本题考查元素周期律知识,本题注意把握元素周期律中电负性的递变规律即可解答,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
下列关于能量转换的认识中不正确的是( )
|
| A. | 电解水生成氢气和氧气时,电能转化为化学能 |
|
| B. | 绿色植物进行光合作用时,太阳能转化为化学能 |
|
| C. | 煤燃烧时,化学能主要转化为热能 |
|
| D. | 白炽灯工作时,电能全部转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、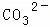 、
、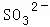 、
、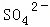 、Cl﹣、
、Cl﹣、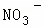 中的一种或几种,取该溶液进行迂续实验,实验内容如下:
中的一种或几种,取该溶液进行迂续实验,实验内容如下:
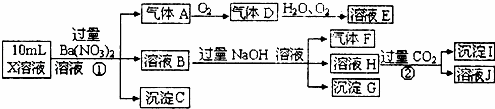
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是,若要确定其中阳离子的存在,最可靠的化学方法是 + .
(2)沉淀G的化学式为 .
(3)写出有关离子方程式:
步骤①中生成A.
步骤②生成沉淀I.
(4)假设测定A、F、I均为0.01mol,10mLX溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是. .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在27.5g水中溶解12.5g CuSO4•5H2O,恰好达到饱和,该溶液密度为1.21g/cm3.求:
(1)该溶液中阴阳离子的总物质的量;
(2)该溶液中CuSO4的物质的量浓度;
(3)取出20.0mL该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
(计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
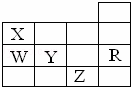
|
| A. | W、R元素单质分子内的都存在非极性键 |
|
| B. | X、Z元素都能形成双原子分子 |
|
| C. | 键能W﹣H<Y﹣H,键的极性Y﹣H>W﹣H |
|
| D. | 键长X﹣H<W﹣H,键能X﹣H<W﹣H |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化或数据与氢键无关的是( )
|
| A. | 水凝结成冰时,密度变小 |
|
| B. | 氨分子与水分子形成一水合氨 |
|
| C. | 水在2000℃时,只有4%的H2O发生分解 |
|
| D. | SbH3的沸点比PH3高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列三个反应:①Cl2+FeI2═FeCl2+I2 ②2Fe2++Br2═2Fe3++2Br﹣③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O.下列说法正确的是( )
|
| A. | ①②③中的氧化产物分别是I2、Fe3+、CoCl2 |
|
| B. | 根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 |
|
| C. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |
|
| D. | 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的用途错误的是( )
|
| A. | 晶体硅是制造太阳能电池的常用材料 |
|
| B. | 二氧化硅是制造光导纤维的材料 |
|
| C. | 氢氟酸可用刻蚀玻璃 |
|
| D. | 硅是制取水泥的原料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com