
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)  H3CuCl4(aq)。
H3CuCl4(aq)。
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl-+2H2O=2CuCl43-+SO42-+4H+
CuCl43-(aq) CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)
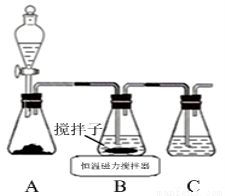
①装置C的作用是 。
②装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。

操作ⅱ的主要目的是 ;操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案: 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
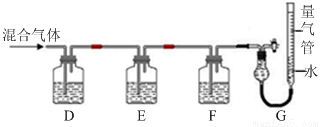
已知:i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
D、F洗气瓶中宜盛放的试剂分别是 、 。
②写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
科目:高中化学 来源:2017届贵州省高三上联考四化学试卷(解析版) 题型:实验题
某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8 ℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:
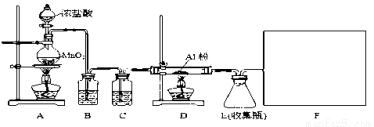
(1)A装置中发生反应的化学方程式为:_________________________
(2)装置B的作用是__________________________
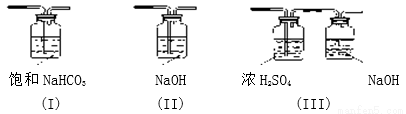
(3)请给标记为F的实线方框选择合适的装置_______
(4)AlCl3遇潮湿空气即产生大量白雾的原因是_________________(结合化学方程式说明)。
(5)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000 mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。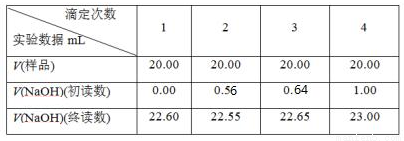
①若本实验需要NaOH标准溶液80mL,则配制该标准溶液需要用到玻璃仪器有玻璃棒,烧杯_______
②经计算,该次滴定测的试样中盐酸浓度为_______________mol·L-1。
③在本实验的滴定过程中,下列操作会使实验结果偏小的是___________(填写序号)。
A.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
B.未用标准NaOH溶液润洗滴定管
C.锥形瓶中加入待测盐酸后,再加少量水
D. 锥形瓶在滴定时剧烈摇动,有少量液体溅出
锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴 定前仰视,滴定后俯视
定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
在加入铝粉能产生氢气的溶液中,下列各组离子可能大量共存的是( )
A.Na+、 Ba2+、Cl-、NO3-
B. Fe2+、 K+、NO3-、Cl-
C.Na+、NH4+、AlO2-、 SO42-
D.NH4+、ClO-、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考五化学试卷(解析版) 题型:填空题
“神十搭载的长征F改进型火箭推进剂之一为无色气体N2O4,N2O4与NO2转换的热化学方程式为:N2O4(g) 2NO2(g) △H=+24.4KJ/mol
2NO2(g) △H=+24.4KJ/mol
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 。
a. v正(N2O4)=2v逆(NO2) b.体系颜色不变
v正(N2O4)=2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色 (填“变深”、“变浅”或“不变”),判断理由 。
(2)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4
CO(g)+3H2(g),经过3min,反应达到平衡。已知平衡时c(CH4 )=0.5mol/L
)=0.5mol/L
①0~3min内,该反应的平均反应速率v(H2)=____________。
②T℃时,该反应的平衡常数K=___________。
(3)在一定条件下用CO和H2可以制得甲醇,CH3OH和C O的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
O的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g) CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
CH3OH(g)。按n(CO) : n(H2)=1 : 2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
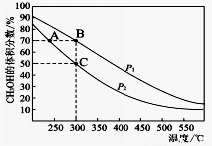
P1_________P2(填“<”“>”或“=”)
②在C点时,CO转化率为____________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考五化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、Al3+、S2-、Cl-
B.无色透明的溶液中:K+、Cu2+、Cl-、NO3-
C.0.1 mol·L-1NH4HCO3 溶液中:K+、Na+、NO3-、Cl
溶液中:K+、Na+、NO3-、Cl
D.常温下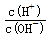 =1012的溶液:Fe2+、I-、NO
=1012的溶液:Fe2+、I-、NO 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考二化学卷(解析版) 题型:选择题
锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–=Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考二化学卷(解析版) 题型:选择题
下列各组离子能在水溶液中大量共存的是
A.Ca2+、SO42-、H+、HCO3- B.H+、NO3-、Cl-、SiO32-
C.K+、Fe2+、H+、NO3- D.K+、Na+、CO32-、SiO32-
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上段考三化学试卷(解析版) 题型:实验题
硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。某校化学兴趣小组,利用工业烧渣为原料,设计如下制备硫酸亚铁的方案。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2 等)制备绿矾(FeSO4·7H2O)。工艺流程如下所示:
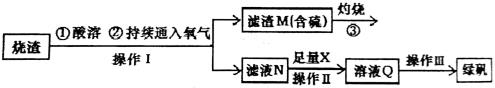
(1)烧渣在进行酸溶时用到了稀硫酸。他们在配制所需的稀硫酸时使用了自来水,有同学提出自来水中含有少量的Cl-,会影响到制出的FeSO4 的纯度。请你设计实验证明已配制的稀硫酸中混有Cl-。
_______________________。
(2)过程③灼烧时产生的气体通入下列溶液中, 溶液不会褪色的是___________
溶液不会褪色的是___________
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.红色的酚酞试液
(3)X 是 , 此时滤液N 中发生反应的离子方程式为 。检验溶液Q 中含有的金属阳离子的实验方法是 。
(4)操作III 的操作步骤为蒸发浓缩、 、过滤( 填操作名称)、  、干燥。
、干燥。
(5)硫酸亚铁可以用于治疗缺铁性贫血症,某严重贫血患者共需补充2.8g铁元素,服用的药品中相当于需要绿矾的质量为_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林长春外国语学校高一上期末理化学卷(解析版) 题型:填空题
铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
(4)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com