
【题目】如图是部分短周期元素原子半径与原子序数的关系图。(X、Y、Z、M、N、P为代号,不为元素符号)则下列说法正确的是( )
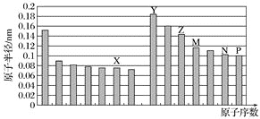
A.Z、N两种元素的离子半径相比,前者较大
B.N、P两种元素的气态氢化物的稳定性相比,前者较稳定
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和P的氢化物的水溶液中
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___(填选项);
A.2v生(NH3)=v耗(CO2)
B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___(填选项);
A.及时分离出CO2气体
B.适当升高温度
C.加入少量NH2COONH4(s)
D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种航天器能量储存系统原理示意图。下列说法正确的是
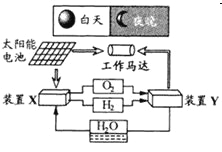
A. 该系统中只存在3种形式的能量转化
B. 装置Y中负极的电极反应式为:![]()
C. 装置X能实现燃料电池的燃料和氧化剂再生
D. 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
(1)A在元素周期表中的位置___,B的离子结构示意图___,化合物NH4D(含D-的铵盐)的电子式___。
(2)C的某种简单阳离子,其原子核中含22个中子,其化学符号为___;元素D最高价氧化物的水化物化学式为___。
(3)B、C、E三种元素的金属性按照由强到弱的顺序排列应为:___(用元素符号表示)。
(4)写出单质B和氢氧化钠溶液反应的离子方程式:___。
(5)写出E与冷水反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(H)常用作食用香精。用芳香烃A为原料先合成肉桂酸G(![]() ),继而合成H的路线如下:
),继而合成H的路线如下:
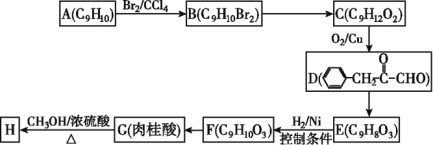
请回答下列问题:
(1)化合物A的结构简式为_____________,D中含有官能团的名称为_________________。
(2)B→C所加试剂的名称是______________,F→G的反应类型为__________。
(3)G→H的化学方程式为______________________________。
(4)写出与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,还能与碳酸氢钠溶液反应的所有同分异构体的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将浓度都是0.1mol·L-1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如图(金属单质E可由滤液C制取):
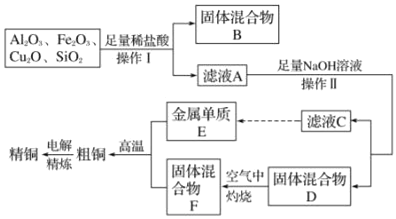
已知:Cu2O+2H+=Cu+Cu2++H2O
(1)固体混合物B的成分是_____。它与NaOH溶液反应的离子方程式为_____。
(2)滤液A中铁元素的存在形式为_____(填离子符号),生成该离子与Fe元素有关的离子反应方程式为_____。要检验该铁元素的离子的实验_____
(3)在滤液C中通入足量CO2的离子方程式为_____
(4)金属单质E从固体混合物F中置换出Cu的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示:
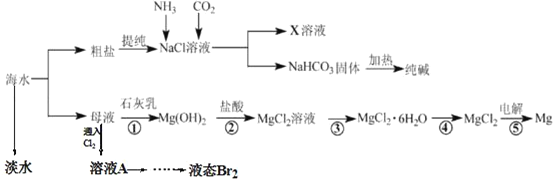
(1)从海水中获得淡水的装置如图,其中有_____处错误。

(2)在母液中通入氯气的离子方程式为_____,从溶液A中提取Br2,需要的主要仪器是____
(3)操作③是_____
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质。
①为制得纯净的NaCl晶体,操作如下:
a.溶解;
b.依次加入过量的_____溶液、NaOH溶液、_____溶液;
c._____;
d.加适量盐酸;
e._____(请补全缺少的试剂和实验步骤)
②步骤b中,加入最后一种试剂发生反应的离子方程式为_____
(5)用这种方法制得的Na2CO3中有少量的NaCl,检验NaCl的实验为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是

A. a点时溶液中所含主要溶质为(NH4)2SO4
B. a→b段发生反应的离子方程式是 SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. b点为最大沉淀量,对应的纵坐标值为0.02
D. c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com