
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 可以通过灼烧时的特殊气味来鉴别蛋白质 | |
| C. | 用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| D. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 |
分析 A.液化石油气、汽油、柴油和润滑油的主要成分都只含C、H元素;
B.蛋白质燃烧具有烧焦羽毛的气味;
C.乙烯和溴发生加成反应生成液态的1,2-二溴乙烷,溴和甲烷不反应;
D.聚乙烯中不含碳碳双键,没有烯烃性质.
解答 解:A.液化石油气、汽油、柴油和润滑油的主要成分都只含C、H元素,所以都是碳氢化合物,故A正确;
B.蛋白质燃烧具有烧焦羽毛的气味,所以可以通过灼烧时的特殊气味来鉴别蛋白质,故B正确;
C.乙烯和溴发生加成反应生成液态的1,2-二溴乙烷,溴和甲烷不反应,所以可以用溴水鉴别甲烷和乙烯,且可以用溴水除去甲烷中的乙烯,故C正确;
D.聚乙烯中不含碳碳双键,没有烯烃性质,所以不能和溴水反应,则不能使溴水褪色,故D错误;
故选D.
点评 本题考查有机物结构和性质、有机物鉴别,为高频考点,明确官能团及其性质关系、物质性质差异性是解本题关键,注意不能用酸性高锰酸钾溶液除去甲烷中的乙烯,易错选项是D.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
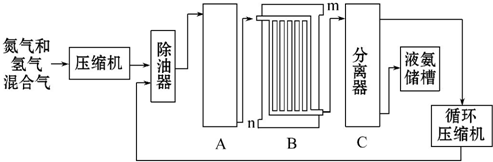
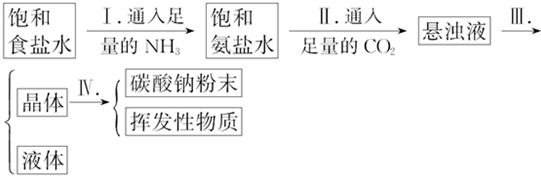
| 温度 盐的溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电作用力形成的化学键,叫离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中不一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使酸性高锰酸钾溶液褪色 | |
| B. | SO2使滴有酚酞的氢氧化钠溶液褪色 | |
| C. | SO2使品红溶液褪色 | |
| D. | SO2使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
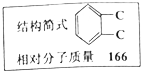 实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.
实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.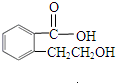 ;
; .
.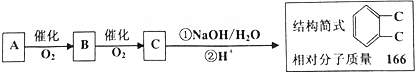
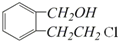 ;
;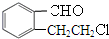 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2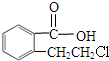 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-445kJ/mol | |
| D. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com