
| c(OH-) |
| c(H+) |
| A、该溶液中由水电离产生的c(H+)=1×10-8mol/L |
| B、0.01mol/LHA的溶液中c(H+)=1×10-4mol/L |
| C、1体积pH=3的HA与10体积pH=11的NaOH混合后溶液中c(OH-)+c(A-)═c(H+)+c(Na+) |
| D、浓度均为0.1 mol/L的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)<c(HA)-c(A-) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、元素周期表有8个主族 |
| B、元素周期表有7个周期 |
| C、IA族的元素全部是金属元素 |
| D、短周期是指第一、二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
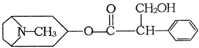 2013年,我国部分地区发生了禽流感.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如图所示,下列是有关金丝桃素说法:其中错误的是( )
2013年,我国部分地区发生了禽流感.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式如图所示,下列是有关金丝桃素说法:其中错误的是( )| A、①和④ | B、②和③ |
| C、①和③ | D、②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、石灰水与过量碳酸氢钠溶液反应:HCO
| ||||
B、向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| C、氧化铜与稀硫酸反应:2H++O2-═H2O | ||||
D、碳酸氢钠溶液中加入盐酸:CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
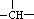 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)| A、4 | B、5 | C、6 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ν正(A)=3 ν逆(B) |
| B、单位时间内生成n molA,同时生成3n molB |
| C、容器内混合气体的平均相对分子质量不变 |
| D、容器内混合气体的密度不随时间而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
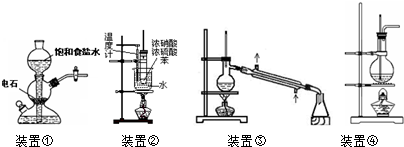
| A、装置①:实验室中若需制备较多量的乙炔可用此装置 |
| B、装置②:实验室中可用此装置来制备硝基苯,但产物中可能会混有苯磺酸 |
| C、装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘 |
| D、装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com