
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A. 浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)
B. 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O)可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15是化工生产中以辉钼矿(主要成分为硫化钼MoS2)为原料来制备金属钼、钼酸钠晶体的主要流程图。

回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X中应控制温度的最佳范围为_______(填序号)。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7)可用还原性气体(CO和H2)还原MoO3制钼,工业上制备还原性气体CO![]() 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法错误的是
A.铝合金大量用于高铁建设B.活性炭具有除异味和杀菌作用
C.生石灰可用作袋装食品干燥剂D.光束通过云、雾会产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜、碱式氯化铜都是重要的无机杀菌剂及饲料中铜的添加剂。
I、碱式碳酸铜的制取:将小苏打配成溶液,先加入反应器中,于50℃时,在搅拌下加入精制的硫酸铜溶液,控制反应温度在70℃~80℃,反应以沉淀变为蓝绿色悬浊液为度,pH值保持在5左右,反应后经静置,沉降,用70℃~80℃蒸馏水洗涤,再用无水乙醇洗涤,再经离心分离、干燥,制得碱式碳酸铜成品。
(1)控制反应温度在70℃~80℃的方法是________________。
(2)控制pH在5左右的原因是______________。
(3)CuSO4溶液与NaHCO3溶液反应制取碱式碳酸铜的化学方程式为________________。
II.碱式氯化铜的制备有多种方法。
(4)如在45℃~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为__________________。
也可采用CuCl2与石灰乳反应生成城式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反成有催化作用,其催化原理如图所示。M的化学式为_______________。

Ⅲ.如图探究实验I所制得的蓝绿色固体。

(5)B 装置的作用是________。C 中盛装的试剂应是_______。D装置加热前,需要如何操作?__________。
(6)若蓝绿色固体的组成xCuCO3·yCu(OH)2,实验能现察到的现象是__________。
(7)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据最新报道,贵州发现超大型锰矿,整个矿区资源量超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家战略紧铁矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、清费大国,回答下列问题:
(1)基态锰原子的价层电子排布式为_________。
(2)铜锰氧化物(CuMn2O4) 能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
①CO 和N2 互为等电于体。CO 分子中σ键和π键数目之比为________。
②HCHO分子的H-C-H 键角______(填“大于”“小于”或“等于”)CO2的键角,理由是__________。
③ 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶被中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。CO32-的空间构型是____________。
(3)晶体熔点: Fe2O3晶体______Al2O3晶体(填“>”“<”或“=”),理由是___________。
(4)锰、铁的第三电离能(I3) 较大的是_______(填素符号)。
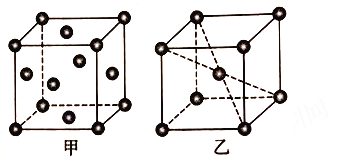
(5) 铝晶胞如图26甲所示。铝晶胞中,铝原子的配位数为________。已知铝的晶体密度为ρ g·cm-3,N A代表阿伏加德罗常数的值,设铝原子的半径为rpm,则r=_______。
(6)锰晶胞如图乙所示。已知锰晶胞参数为a nm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_____。锰晶胞中Mn 的空间利用率φ=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有32 g某气体,摩尔质量为16 g·mol-1,则:
①该气体为___________ mol。
②该气体所含分子数为___________ NA。
③该气体在标准状况下的体积为_________ L。
(2) _________g H2O中的氧原子数目与标准状况下4.48 L CO2中的氧原子数目相同。
(3)同温同压下,同体积的氨气(NH3)和氧气的质量比是______,相同质量的氨气和氧气的体积比是_________;
(4)某元素1个原子的质量为a g,1 个 12C原子质量为b g,则该元素的这种原子的相对原子质量数值是_________或_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列化学实验安全的有关问题:
(1)在盛放浓硫酸的试剂瓶的标签上应印有下列警示标志中的______。
A.  B.
B. C.
C. D.
D.
(2)下列做法正确的是__________(填序号)。
①蒸发时,用手直接拿蒸发皿
②实验室中用![]() 制备并用排水法收集
制备并用排水法收集![]() ,实验结束时,先撤酒精灯,再撤导气管
,实验结束时,先撤酒精灯,再撤导气管
③给试管中的液体加热时,试管口不要朝着任何人
④向燃着的酒精灯中添加酒精
⑤熄灭酒精灯时应用灯帽盖灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com