
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 标准状况下,9克H2O 含有的分子数为0.5NA | |
| C. | 常温常压下,32g O2和O3的混合气体所含原子数为2NA | |
| D. | 1mol Fe和足量稀盐酸反应,铁失去的电子数为2NA |
分析 A.氦气为氮原子分子;
B.质量转化为物质的量,依据N=NA×n;
C.O2和O3都是由氧元素组成的,即氧元素的质量为32g;
D.Fe和足量稀盐酸反应生成二价铁离子.
解答 解:A.氦气为氮原子分子,含有NA个氦原子的氦气物质的量为1mol,在标准状况下的体积约为22.4L,故A错误;
B.9克H2O的物质的量为=$\frac{9g}{18g/mol}$=0.5mol,含有的分子数0.5×NA=0.5NA,故B正确;
C.O2和O3都是由氧元素组成的,即氧元素的质量为32g,所以氧原子数为$\frac{32g}{16g/mol}$×NAmol-1=2NA,故C正确;
D.1mol Fe和足量稀盐酸反应生成1mol氯化亚铁,铁失去的电子数为2NA,故D正确;
故选:A.
点评 本题考查了阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意气体摩尔体积使用的条件.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | 反应热的关系:2b=c | D. | 反应热的关系:a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
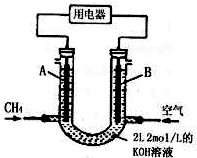 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3200}{m}$ | B. | $\frac{32}{100m}$ | C. | 3200m | D. | $\frac{m}{3200}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com