
����Ŀ��2013��12��2�գ����϶�������̽�����ɳ������������ػ�����������Ƿ������ķ��䣬�״�ʵ����������½������Ѳ�ӿ��졣��������ϵ�л����ƫ������(C2H8N2)��ȼ�ϣ������������������������ɵ����Ͷ�����̼���塣
��1��д����Ӧ�Ļ�ѧ����ʽ��_____________________________________________��
��2���÷�Ӧ��________(��������������������)��Ӧ����Ӧ���������________(������������С��������������)����������������Ͽ���ѧ��________��������С���γɻ�ѧ��________�������������������������ų�������
��3�����һ����Ӧ���Էּ������У�����ֲ���Ӧ�ķ�Ӧ��֮����÷�Ӧһ�����ʱ�ķ�Ӧ������ͬ�ģ�������ɳ�Ϊ��˹���ɡ��ݴ˻ش��������⡣
��֪��Na2CO3��10H2O(s)===Na2CO3(s)��10H2O(g)��H1����532.36kJ��mol��1
Na2CO3��10H2O(s)===Na2CO3��H2O(s)��9H2O(g) ��H2����473.63kJ��mol��1
д��Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ____________________��
���𰸡�C2H8N2��2N2O4![]() 2CO2����3N2����4H2O ���� ���� ���� �ų� Na2CO3��H2O(s)===Na2CO3(s)��H2O(g) ��H����58.73 kJ/mol
2CO2����3N2����4H2O ���� ���� ���� �ų� Na2CO3��H2O(s)===Na2CO3(s)��H2O(g) ��H����58.73 kJ/mol
��������
����������ϵ�л����ƫ������(C2H8N2)��ȼ�ϣ������������������������ɵ����Ͷ�����̼���塣
��ȼ�շų������ȣ���Ӧ����������������������������
�ǽ���1������ʽ��ȥ��2������ʽ�õ�Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ��
����������ϵ�л����ƫ������(C2H8N2)��ȼ�ϣ������������������������ɵ����Ͷ�����̼���壬��˷�Ӧ�Ļ�ѧ����ʽ��C2H8N2��2N2O4![]() 2CO2����3N2����4H2O���ʴ�Ϊ��C2H8N2��2N2O4
2CO2����3N2����4H2O���ʴ�Ϊ��C2H8N2��2N2O4![]() 2CO2����3N2����4H2O��
2CO2����3N2����4H2O��
��ȼ�շų������ȣ���˸÷�Ӧ�Ƿ��ȷ�Ӧ����H= ��������������Ӧ�������� = �ϼ����յ������ɼ��ų���������0����˷�Ӧ�����������������������������Ͽ���ѧ�����յ�������С���γɻ�ѧ���ų������������ʴ�Ϊ�����ȣ����ڣ����գ��ų���
�ǽ���1������ʽ��ȥ��2������ʽ�õ�Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽNa2CO3��H2O(s) = Na2CO3(s)��H2O(g) ��H����58.73 kJ��mol1���ʴ�Ϊ��Na2CO3��H2O(s) = Na2CO3(s)��H2O(g) ��H����58.73 kJ��mol1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ(������)����ʽ�У�������ȷ���ﷴӦ��ɫ�仯����
A.��ⱥ��ʳ��ˮ��������ɫ���壺2NaCl+2H2O![]() 2NaOH+H2��+Cl2��
2NaOH+H2��+Cl2��
B.����ľ̿��Ũ�����������ɫ���壺C+4HNO3(Ũ) ![]() CO2��+4NO2��+2H2O
CO2��+4NO2��+2H2O
C.Na2O2�ڳ�ʪ�Ŀ����з���һ��ʱ�䣬��ɰ�ɫ���2Na2O2+2CO2=2Na2CO3+O2
D.��Ca(ClO)2��Һ��ͨ������SO2�����ְ�ɫ����SO2+Ca2++3ClO+H2O=CaSO4��+2HClO+Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A. ![]() ��������
��������![]()
B. ��![]() ��Һ�ӳ��¼�����
��Һ�ӳ��¼�����![]() ����Һ��
����Һ��![]() ��С���Ա�������
��С���Ա�������
C. �����£�![]() ��Һ�ʼ��ԣ�˵��
��Һ�ʼ��ԣ�˵��![]() ���������
���������
D. �����£�![]() Ϊ3�Ĵ�����Һ�м�������ƹ��壬��Һ
Ϊ3�Ĵ�����Һ�м�������ƹ��壬��Һ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �ǹ�����ˮ�����Ҫ�ɷ�֮һ����������ʵ�˵������ȷ����( )
�ǹ�����ˮ�����Ҫ�ɷ�֮һ����������ʵ�˵������ȷ����( )
A. �ɷ�����Ӧ��![]()
B. ������ˮ�ԣ���Ҫ�ܷⱣ��
C. ����![]() ����Ӧ��������
����Ӧ��������
D. �������������ã����ù��������ҪΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��̬�⻯�����ȶ���![]() ����
����![]() ����Ҫԭ����__________��
����Ҫԭ����__________��
(2)![]() �����ӻ������ԭ�Ӿ�����8�����ȶ��ṹ��
�����ӻ������ԭ�Ӿ�����8�����ȶ��ṹ��![]() �ĵ���ʽ��_______��
�ĵ���ʽ��_______��
(3)�����£���ˮ�е��ܽ���Ҵ����������飬ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����«���㷺������ʳ�����ɣ�������������������ѣ��У������ܾ��п����ԡ��ܹ���1 mol�û��������Ӧ��Br2��H2����������ֱ��ǣ� ��
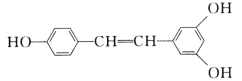
A.1mol��1molB.3.5mol��7mol
C.3.5mol��6molD.6mol��7mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���C��Si���仯����ṹ�����ʵ������������
A.����![]() ��
��![]() �����C2H6�ȶ��Դ���Si2H6
�����C2H6�ȶ��Դ���Si2H6
B.������SiC������ʯ�ɼ����ṹ�����ƵĹ��۾��壬��˾��кܸߵ�Ӳ��
C.SiH4��Si�Ļ��ϼ�Ϊ+4��CH4��C�Ļ��ϼ�Ϊ-4�����SiH4��ԭ��С��CH4
D.Siԭ�Ӽ����γ�˫����Cԭ�Ӽ���ԣ�����ΪSi��ԭ�Ӱ뾶����C�����γ�![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ������ɹ��ϳ������������嵪��������(N5)6(H3O)3(NH4)4Cl(��R����)����X����������R�ľֲ��ṹ��ͼ��ʾ������˵����ȷ���ǣ� ��
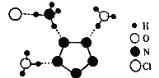
A.R�����������ӵ�����ԭ�ӵ��ӻ����������ͬ������ѧ�����Ͳ�ͬ
B.1molR����������Ϊ15��
C.N5-�в����γɵĴ�����������Ϊ6��
D.��֪ͼ�����ߴ������������һ����ʾΪ��NH4��N��H������Cl������R�й���4����ͬ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��Co��Ni��������Ҫ�Ľ���Ԫ�ء��ش���������:
(1)Fe��Co��Ni�����ڱ��е�λ��Ϊ_________����̬Feԭ�ӵĵ����Ų�ʽΪ__________��
(2)CoO����������������ͼ��ʾ���谢���ӵ�������ֵΪNA����CoO������ܶ�Ϊ______g�qcm-3������Ԫ�ض���������ľ���������ͬ�����۵��ɸߵ��͵�˳��Ϊ_______��

(3)Fe��Co��Ni����C12��Ӧ������Co��ΪNi���������Ȼ���ɴ��ƶ�FeCl3��CoCl3��Cl2����������ǿ������˳��Ϊ____��Co(OH)3�����ᷴӦ�л���ɫ�������ɣ�д����Ӧ�����ӷ���ʽ��______��
(4)95��ʱ����NiƬ���ڲ�ͬ���������������У���4Сʱ��ʴ���������ʧ�����ͼ��ʾ����![]() ����63%ʱ��Ni����ʴ���������͵Ŀ���ԭ��Ϊ_____������Ni��H2SO4��Ӧ����������ϡ���ᷴӦ�ܿ죬��ҵ��ѡ��H2SO4��HNO3�Ļ�����Ni��Ӧ�Ʊ�NiSO4��Ϊ����߲���Ĵ��ȣ�������������HNO3�ķ�ʽΪ______(����һ�ι������������������)���˷��Ʊ�NiSO4�Ļ�ѧ����ʽΪ_______��
����63%ʱ��Ni����ʴ���������͵Ŀ���ԭ��Ϊ_____������Ni��H2SO4��Ӧ����������ϡ���ᷴӦ�ܿ죬��ҵ��ѡ��H2SO4��HNO3�Ļ�����Ni��Ӧ�Ʊ�NiSO4��Ϊ����߲���Ĵ��ȣ�������������HNO3�ķ�ʽΪ______(����һ�ι������������������)���˷��Ʊ�NiSO4�Ļ�ѧ����ʽΪ_______��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com