
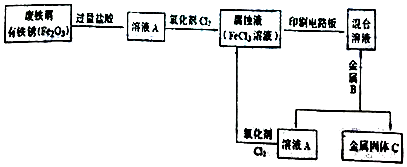
分析 (1)氧化性与还原性越强,越易发生氧化还原反应;
(2)废铁屑与铁锈中加入过量盐酸,得到的A含有氯化亚铁,加入氧化剂氯气,可氧化氯化亚铁生成氯化铁,用于印刷电路板,得到的混合液含有氯化铜和氯化亚铁,加入金属B为Fe,金属固体C为铜,A为氯化亚铁,以此解答该题.
解答 解:(1)还原性Fe>Cu,氧化性Fe3+>Cu2+,氧化性与还原性越强,越易发生氧化还原反应,则首先发生反应的离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(2)废铁屑与铁锈中加入过量盐酸,得到的A含有氯化亚铁,加入氧化剂氯气,可氧化氯化亚铁生成氯化铁,用于印刷电路板,得到的混合液含有氯化铜和氯化亚铁,加入金属B为Fe,金属固体C为铜,A为氯化亚铁,
溶液A含有氯化亚铁,可与氯气发生2Fe2++Cl2=2Fe3++2Cl-,混合液含有氯化铜和氯化亚铁,加入金属B为Fe,发生置换反应,离子方程式为Fe+Cu2+=Cu+Fe2+,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;Fe+Cu2+=Cu+Fe2+;
(3)检验铁离子,可加入KSCN,发生络合反应,溶液呈现血红色,故答案为:KSCN;呈现血红色;
(4)还原性Fe>Cu,氧化性Fe3+>Cu2+,加入一定量的铁粉,首先和铁离子反应,在和铜离子反应,若反应结束后试管中仍有少量固体,则一定含有铜,溶液中一定含有亚铁离子,可能含有铜离子,
故答案为:Cu; Cu2+.
点评 本题考查物质的分离和制备,为高频考点,侧重考查铁与铜的化合物的转化,明确实验的目的与原理是解题的关键,注意掌握氯气的化学性质及检验方法,试题侧重考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
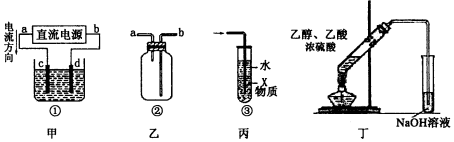
| A. | 装置丁可用于实验室制取并收集乙酸乙酯 | |
| B. | 装置乙可用于收集H2、NH3、CO2、Cl2、NO等气体 | |
| C. | 装置丙中X若为苯,可用于吸收氨气或氯化氢等易溶于水的气体,并能防止倒吸 | |
| D. | 装置甲中,d为阴极、c为阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 降低温度时,弱酸和弱碱的电离常数(Ka、Kb)、水的离子积(Kw)均增大 | |
| C. | 向稀NaOH溶液中加入等体积等浓度的氯化镁和氯化铁混合溶液时,先产生红褐色沉淀,说明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] | |
| D. | 室温下,Kh(CH3COONa)<Kh(NaCN),则等物质的量浓度时,CH3COOH的酸性比HCN弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| C. | 可溶性铁盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | C3H6与C4H8一定互为同系物 | |
| C. | 全降解塑料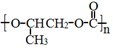 可由环氧丙烷 可由环氧丙烷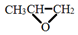 和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、MgO、Fe3O4均为金属氧化物,并且都是碱性氧化物 | |
| B. | CH3COONa、CuSO4、NaOH、H2S水溶液均能导电,并且都是强电解质 | |
| C. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都含有铁元素,并且都是常见的铁矿石 | |
| D. | HClO、H2SO4、HNO3均具有氧化性,并且都是氧化性酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl反应,转移的电子数为3NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
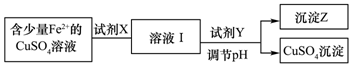
| 金属 离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com