
����Ŀ�����⻯��(NaAlH4)���л��ϳɵ���Ҫ��ԭ������ϳ���·����ͼ��ʾ��
![]()
��1�����⻯����ˮ�������ҷ�Ӧ���䷴Ӧ�Ļ�ѧ����ʽΪ__________________________��
��2��AlCl3��NaH��Ӧʱ���轫AlCl3�����л��ܼ����ٽ��õ�����Һ�μӵ�NaH��ĩ�ϣ��˷�Ӧ��NaH��ת���ʽϵ͵�ԭ����__________________________________________��
��3��ʵ����������ͼװ����ȡ��ˮAlCl3��
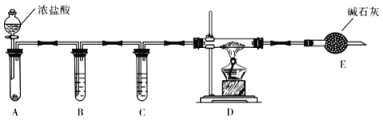
��A����ʢװ���Լ���_______________��
�ڵ�ȼD���ƾ���֮ǰ���ų�װ���еĿ������������____________________________
��4���ı�A��D�е��Լ��Ϳ����ø�װ����ȡNaH����װ���в������������Ƶõ�NaH�п��ܺ��е�����Ϊ____________ ��
��5���������������װ�ã��ⶨ���⻯�ƴֲ�Ʒ(ֻ����NaH����)�Ĵ��ȡ�
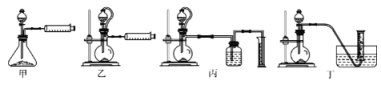
�Ӽ�Լ�ԡ�ȷ�Կ��ǣ������˵�װ����_________(����)����ȡ15.6g��Ʒ��ˮ��ȫ��Ӧ��������ڱ�״���µ����Ϊ22.4L����Ʒ�����⻯�Ƶ�����Ϊ___________��
���𰸡�NaAlH4+2H2O=NaAlO2+4H2�� ��Ӧ���ɵ�NaCl������NaH����,��ֹAlCl3��NaH��Ӧ�Ľ��С���:NaHΪ���ӻ�����,�������л��ܼ�,ʹ��Ӧ�����ԽӴ�������Ӧ KMnO4��KClO3��K2Cr2O7��Ca(ClO)2�� ��Һ©������ʹA�з�����Ӧ,��D�г�������ɫ����ʱ��ȼ�ƾ��� Na2O2 �� 10.8 g
��������
��1�����⻯����ˮ�������ҷ�Ӧ����ƫ�����ƺ�������
��2��NaCl�����ӻ�������л���֮�以�����ܣ����Է�Ӧ���ɵ��Ȼ��Ƴ������⻯�Ʊ��棬��ֹ���Ȼ������⻯�ƽ�һ����Ӧ��
��3���Ȼ������Ʊ��ǽ�����������֮�䷴Ӧ�IJ��Ũ���������أ�����ػ��ظ���أ�֮���������ķ�Ӧ���������������ǽ������ױ��������������ʣ����Ե�ȼD���ƾ���֮ǰ���ų�װ���еĿ�����
��4�������ƺ�����֮�仯�Ͽ��Ե�NaH�����������е��Ȼ���Ҫ��ȥ�������ƺ����������»���������������ʣ�
��5���Ӽ�Լ�ԡ�ȷ�Կ��ǣ��ײ����������ʲ����ȣ������������к��д������������ݷ���ʽ�����ݹ�������������֮���ϵʽ�з���ʽ����������⻯��������
��1�����⻯����ˮ�������ҷ�Ӧ����ƫ�����ƺ��������䷴Ӧ�Ļ�ѧ����ʽΪNaAlH4+2H2O=NaAlO2+4H2�����ʴ�Ϊ��NaAlH4+2H2O=NaAlO2+4H2����
��2��AlCl3��NaH��Ӧʱ���轫AlCl3�����л��ܼ����ٽ��õ�����Һ�μӵ�NaH��ĩ�ϣ������ɵ�NaCl�����ӻ�������л���֮�以�����ܣ����Է�Ӧ���ɵ��Ȼ��Ƴ������⻯�Ʊ��棬��ֹ���Ȼ������⻯�ƽ�һ����Ӧ������NaH��ת���ʽϵͣ��ʴ�Ϊ����Ӧ���ɵ��Ȼ��Ƴ������⻯�Ʊ��棬��ֹ���Ȼ������⻯�ƽ�һ����Ӧ��
��3�����Ȼ������Ʊ��ǽ�����������֮�䷴Ӧ�IJ����װ��AΪ�Ʊ������ķ���װ�ã�Ũ���������أ�����ػ��ظ���أ�֮���������ķ�Ӧ����������������A����ʢװ���Լ�������Ϊ������أ�����ػ��ظ���أ����ʴ�Ϊ��������أ�����ػ��ظ���أ���
����Ϊ�������ױ��������������ʣ����Ե�ȼD���ƾ���֮ǰ���ų�װ���еĿ���������Һ©���Ļ���ʹA�з�����Ӧ����D�г�������ɫ������ʱ��ȼ�ƾ��ƣ��ʴ�Ϊ����Һ©���Ļ���ʹA�з�����Ӧ����D�г�������ɫ������ʱ��ȼ�ƾ��ƣ�
��4�������ƺ�����֮�仯�Ͽ��Ե�NaH�����������е��Ȼ���Ҫ��ȥ�������ƺ����������»���������������ʣ��ʴ�Ϊ��Na2O2��
��5���Ӽ�Լ�ԡ�ȷ�Կ��ǣ��ײ����������ʲ����ȣ������������к��д��������������⼸��װ�����ϴ�ѡ�ң�15.6g��Ʒ��ˮ��Ӧ�Ļ�ѧ����ʽΪ��NaAlH4+2H2O=
NaAlO2+4H2����NaH+H2O=NaOH+H2������n��NaAlH4��=xmol��n��NaH��=ymol���ɷ���ʽ���������ݵ���������ʽ��4x+y=1��54x+24y=15.6������������ʽ�ɵ�x=y=0.2mol����m��NaAlH4��=0.2mol��54g/mol=10.8g���ʴ�Ϊ���ң�10.8g��


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں�ѹ�ܱ������У�����һ������H2��CO2 �������¿��淴Ӧ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H ��0��ʵ���÷�Ӧ���ڲ�ͬ�¶��£���Ӧ��ϵ��CO2��ƽ��ת������ѹǿ�Ĺ�ϵ������ͼ��ʾ��
CH3OH��g��+H2O��g����H ��0��ʵ���÷�Ӧ���ڲ�ͬ�¶��£���Ӧ��ϵ��CO2��ƽ��ת������ѹǿ�Ĺ�ϵ������ͼ��ʾ��
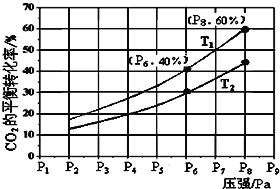
��1���÷�Ӧ�Ħ�S______0��������÷�Ӧ��_______������¡����¡��������������Է����У�
��2���Ƚ�T1��T2�Ĵ�С��ϵ��T1__T2�����������������������������_______��
��3����T1��P6�������£����ܱ������г���3 mol H2��1 mol CO2���÷�Ӧ�ڵ�5 minʱ�ﵽƽ�⣬��ʱ���������Ϊ1.8 L����÷�Ӧ�ڴ��¶��µ�ƽ�ⳣ��Ϊ____�����¶Ȳ��䣬ѹǿ�㶨��P8�����������´ﵽƽ��ʱ�������������Ϊ_____L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֬������֬�����ܳƣ����Ƕ��ָ�֬����ĸ���������֬������Ҫʳ��,������Ҫ�Ļ���ԭ�ϡ���֬��������;���京�е�̼̼�����ͼ�(![]() )�йص���
)�йص���
A. �·��ϵ���֬��������ϴȥ
B. ����������֬,�������������ն���֬����ά���غͺ��ܲ���
C. ֲ����ͨ���⻯��������ֲ������(��������)
D. ֬�����л�����֯�ﴢ����������Ҫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���������ȷ����(����)
A.��3����B
B.��18��Ϊ0A
C.��14����A
D.��8����B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��¿��淴Ӧ��Fe2(SO4)3��6KSCN![]() 2Fe(SCN)3��3K2SO4�ﵽƽ��״̬������������к��ֹ������ʣ���ƽ�⼸���������ƶ�( )
2Fe(SCN)3��3K2SO4�ﵽƽ��״̬������������к��ֹ������ʣ���ƽ�⼸���������ƶ�( )
A. NH4SCN B. K2SO4 C. NaOH D. FeCl3��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����FeCl3������Һ�м�����п����Fe3+��������ԭ��Fe2+���ݴ�ijѧϰС�������ͼ��ʾ��ԭ���װ�á������й�˵����ȷ����
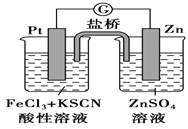
A. ������ӦΪZn-2e��=Zn2+
B. �õ���ܷ�ӦΪ3Zn+2Fe3+��2Fe+3Zn2+
C. Pt�缫�������ݳ���
D. ���ձ�����Һ�ĺ�ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦN2��3H2 ![]() 2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��
2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��
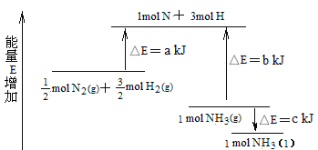
A��N2(g)��3H2(g) ![]() 2NH3(l) ��H �� 2(a��b��c) kJ/mol
2NH3(l) ��H �� 2(a��b��c) kJ/mol
B��N2(g)��3H2(g) ![]() 2NH3(l) ��H �� 2(a��b��c) kJ/mol
2NH3(l) ��H �� 2(a��b��c) kJ/mol
C��![]() N2(g)��
N2(g)��![]() H2(g)
H2(g) ![]() NH3(l) ��H �� (b��c��a) kJ/mol
NH3(l) ��H �� (b��c��a) kJ/mol
D��![]() N2(g)��
N2(g)��![]() H2(g)
H2(g) ![]() NH3(g) ��H �� (a��b) kJ/mol
NH3(g) ��H �� (a��b) kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܴ���Fe3����Fe2����I����HCO![]() ��Cl����NO
��Cl����NO![]() ���������еļ��֡���������ʵ�飺
���������еļ��֡���������ʵ�飺
��ȡ������Һ�μ�KSCN��Һ����Һ�ʺ�ɫ��
����ȡ����ԭ��Һ�μ����ᣬ��Һ���ػ�ɫ���
�ݴ˿����ƶϣ�����Һ��һ���������ڵ���������(����)
A. I�� B. HCO![]() C. Cl�� D. NO
C. Cl�� D. NO![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com