

分析 用NaClO3制取ClO2气体,再由ClO2 制得NaClO2,由实验装置可知,装置A中盛放硫酸、NaClO3和Na2SO3,反应生成ClO2气体,ClO2气体和H2O2在B发生发生反应,反应能使装置内压强降低,可能发生倒吸,装置C为防倒吸装置,装置D为尾气吸收装置;
(1)仪器a为分液漏斗;装置C为防止倒吸装置;
(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全;
(3)缓慢通入ClO2可以使ClO2气体能被均匀、充分吸收;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,根据氧化还原反应规律来书写;
(5)B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可;
(7)根据元素守恒进行计算即可.
解答 解:实验过程分析:装置A中盛放硫酸、NaClO3和Na2SO3,反应生成ClO2气体:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,ClO2气体和H2O2在B发生发生氧化还原反应:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2,发生反应可能使装置内压强降低,可能发生倒吸,装置C为防倒吸装置,装置D为尾气吸收装置;
(1)根据图示可知仪器a为分液漏斗;
亚硫酸钠具有还原性,在反应中作还原剂;装置A中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,ClO2进入装置B,发生反应使装置内压强降低,可能发生倒吸,装置C的作用为防止倒吸;
故答案为:分液漏斗;防止倒吸;
(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全,所以该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2,
故答案为:使Na2SO3完全反应,避免产生SO2;
(3)缓慢通入ClO2,可以使ClO2气体被均匀、充分吸收,ClO2是硫酸、NaClO3与亚硫酸钠反应生成的,所以要使ClO2气体能被均匀、充分吸收,应该控制控制硫酸滴入速度;
故答案为:控制硫酸滴入速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-;
故答案为:ClO3-;
(5)B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应制得NaClO2,二氧化氯中Cl为+4价,变为NaClO2中的+3价,化合价变低,过氧化氢中的元素化合价应该升高,则H2O2中O元素化合价由-2价变为0价,产物为O2和H2O,反应的离子方程式为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2↑,
故答案为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2↑;
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入非氧化性酸酸化,再加入含Fe2+的化合物,若有Fe3+生成,则证明NaClO2具有氧化性,用KSCN溶液检验Fe3+,现象是溶液变红;
故答案为:②;⑤⑥;
(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,故答案为:②;⑤⑥;
(7)28.9 g NaClO2•3H2O(式量:144.5),n(NaClO2•3H2O)=$\frac{m}{M}$=$\frac{28.9g}{144.5g/mol}$=0.2mol,
根据氯原子守恒知:n(NaClO3)=n(NaClO2•3H2O)=0.2mol,m(NaClO3)=n(NaClO3)•M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为:$\frac{21.3g}{80%}$≈26.6g,
故答案为:26.6.
点评 本题考查制备方案的设计,是一道化工生产过程中的工艺流程为载体的实验题,题目难度中等,需要把握住工艺流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品进行分析,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉漂白物质时发生的发应和变质失效时的反应一样 | |
| B. | 将氯气溶于水中,当水中各成分浓度保持不变时,即表示反应停止 | |
| C. | 二氧化硅固体是由原子直接构成的,那么固态二氧化碳也是由原子直接构成 | |
| D. | 碱金属(如钾、钠等)可以存放在所有有机溶剂中,而白磷则应保存在水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合后溶液pH=7 | |
| B. | 所得混合溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 所得混合溶液中存在c(CH3COOH)+c(CH3COO-)=0.05molL-1 | |
| D. | 混合后溶液中存在c(Na+)+c(H+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大 | |
| C. | 随核电荷数递增,氢氧化物碱性增强 | |
| D. | 随电子层数增加,原子半径增大,金属还原性和金属性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

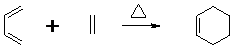
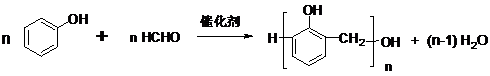
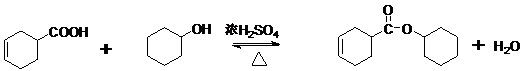
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片跟氢氧化钠溶液反应 6H2O+2Al+2OH?═2[Al(OH)4]-+3H2↑ | |
| B. | 明矾溶液中加入过量的氨水 Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| C. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3-+OH-═CO32-+2H2O | |
| D. | 铜片跟稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的硫酸溶液时,只需使用1次玻璃棒 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时即停止加热 | |
| C. | 液溴盛放在用水液封的棕色试剂瓶中 | |
| D. | 用四氯化碳萃取碘的饱和水溶液中的碘.分液时显紫红色液体在下层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
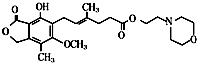
| A. | ①③⑦⑧ | B. | ③④⑥⑦ | C. | ①④⑤⑥ | D. | ②④⑤⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com