
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
分析 (1)①考虑生成的熔融的铁的还原性,可以被空气中的氧气氧化导致生成三价的铁;
②根据铝与铁的性质的差异性来选择试剂,并写出反应的化学方程式;
(2)①确保A组实验在39℃下进行,可以采用水浴加热的方法;
②探究化学反应速率的影响因素时,需要保证变量的唯一性;
③根据“淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色”进行判断;
④根据ABC探究的是温度对反应速率的影响可知,D应该为探究酸度对反应速率的影响,据此完成本题;
⑤依据酸的体积确定溶液的酸度,由4H++4I-+O2=2I2+2H2O可知,溶液酸度越大,生成碘的速率越快,与同温度的实验相比,看到蓝色的时间越短.
解答 解:(1)①铝热反应生成的熔融的铁具有很强的还原性,可以被空气中的氧气氧化导致生成三价的铁,
故答案为:熔融的铁被空气中氧气氧化;
②要证明“铁块”中含有金属铝,应利用铁和铝性质的差异性,即铁不能和碱反应,而铝可以,故应选择氢氧化钠溶液,与铝反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NaOH;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)①为确保A组实验在39℃下进行,应采用的控温操作方法为:将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度,
故答案为:将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度;
②为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变,所以在A-C三组实验时,都加入了5mL水,
故答案为:为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变;
③淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色,所以B组实验中“没出现蓝色”,可能是温度(TB)高于75℃,淀粉与碘不显色,
故答案为:温度(TB)高于75℃,淀粉与碘不显色;
④A-C三组实验探究了温度对反应速率的影响,实验的目的是探究温度和酸度对反应速率的影响,则D的目的是探究酸度对反应速率的影响,所以温度可以为39或5℃,硫酸体积可以为15mL,水、碘化钾溶液的体积为5mL,淀粉溶液为1mL,
故答案为:
| D | 39或5 | 10加减5范围内的一个数值 | 5 | 5减加5范围内的一个数值 | 1 |
点评 本题考查了铝热反应原理、探究影响化学反应速率的因素,题目难度中等,注意掌握探究影响化学反应速率的因素,明确铝热反应原理,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加AgNO3溶液,看是否有白色沉淀 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HCl,看白色沉淀是否消失 | |
| D. | 取样,加少量AgNO3溶液,有白色沉淀,再加稀HNO3,看白色沉淀是否消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

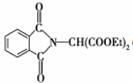 .
.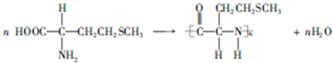 .
.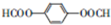 .
.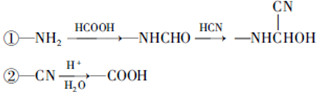
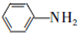 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物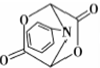 的流程如下:
的流程如下: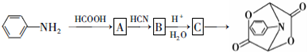
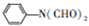 ,C
,C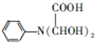 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
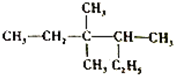
| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
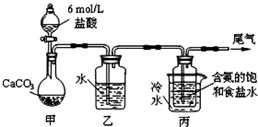 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C在反应中被还原 | B. | S和KNO3都发生了还原反应 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com