
����Ŀ��±���������������о��й㷺��Ӧ�ã��ش��������⣺
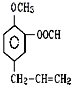
(1)��һ�ֶ��ȴ�����Ϊ�����л��ܼ�������ӽṹΪ�������壬����______(д��ѧʽ)
(2)���ķ���ϩ�ȶ��������Dz�ճ����Ϳ�㣬���Ľṹ��ʽ��________________
(3)��֪�Ҷ����������ᣬ�ڹ�ҵ���й㷺����;���������кϳ�·����գ�

�ֱ�д����Ӧ�ڢ۵Ļ�ѧ��Ӧ����ʽ��________��_____________��
(4)��Ҫ������������⣺�� �ٱ� ���Ҵ� �ۼױ� �������� ��![]() ��
�� ��
��![]() ����������(����)��
����������(����)��
���ܺͽ����Ʒ�Ӧ�ų�H2����________��
�ڳ�����������ˮ��ѧ��Ӧ����________��
����ʹ����KMnO4��Һ��ɫ����________��
���𰸡�CCl4 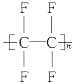 CH2ClCH2Cl+2NaOH��CH2OHCH2OH+2NaCl CH2OHCH2OH +O2��CHOCHO+2H2O �ڢ� �ݢޢ� �ڢۢݢޢ�
CH2ClCH2Cl+2NaOH��CH2OHCH2OH+2NaCl CH2OHCH2OH +O2��CHOCHO+2H2O �ڢ� �ݢޢ� �ڢۢݢޢ�
��������
(1) ���ȴ������з��ӽṹΪ���������Ϊ���Ȼ�̼������ʽΪCCl4��
(2) ���ķ���ϩΪ�ķ���ϩ��CF2=CF2���ļӾ۲���ṹ��ʽΪ ��
��
(3) ��Ӧ��Ϊ±������ˮ�⣬����ʽΪ��CH2ClCH2Cl+2NaOH��CH2OHCH2OH+2NaCl��
��Ӧ��Ϊ�ǻ�����������ȩ��������ʽΪ��CH2OHCH2OH +O2��CHOCHO+2H2O��
(4) ���ܺͽ����Ʒ�Ӧ�ų�H2���л��ﺬ���ǻ����Ȼ�����ѡ�ڢݣ�
�� ������������ˮ�����ӳɷ�Ӧ���л���Ӧ�ú���̼̼˫����̼̼�����������������Тޣ����߷��ǻ��ڶ�λ����ȡ����Ӧ�������������Тݣ����߷���������Ӧ������ȩ�����Ա����������������Ǣߣ���ѡ�ݢޢߣ�
�� ��ʹ����KMnO4��Һ��ɫ���л��ﺬ���ǻ���ȩ����̼̼˫����ױ�����ѡ�ڢۢݢޢߡ�


 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ʱ����
ʱ����![]() �в��ϵ���
�в��ϵ���![]() �������ҺpH�仯��ͼ��ʾ���˹�����Һ����˵������ȷ����
�������ҺpH�仯��ͼ��ʾ���˹�����Һ����˵������ȷ����![]() ��֪��
��֪��![]() ʱһԪ��
ʱһԪ��![]() ����ƽ�ⳣ��
����ƽ�ⳣ��![]()

A.a����Һ��pH����3
B.b����Һ�����ӣ�![]()
C.c���ʾ��![]() ��
��![]() ��Һǡ����ȫ��Ӧ
��Һǡ����ȫ��Ӧ
D.d����Һ��ˮϡ�ͺ�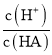 ��ֵ������
��ֵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
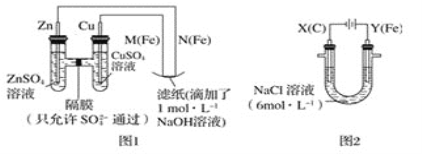
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����
��ش�
��.��ͼ1��ʾװ�ý��е�һ��ʵ�顣
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫����___������ĸ��ţ���
A.�� B.ʯī C.�� D.��
��2��N��������Ӧ�ĵ缫��ӦʽΪ___��
��3��ʵ������У�SO42-___�����������������������������������������ƶ�����ֽ���ܹ۲쵽�������У�___��
��.��ͼ2��ʾװ�ý��еڶ���ʵ�顣ʵ������У��۲쵽���һ��ʵ�鲻ͬ�����������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ���塣�������ϵ�֪������������ӣ�FeO42-������Һ�г��Ϻ�ɫ��
��4���������У�X������Һ��pH___����������������С����������������
��5���������У�Y�������ĵ缫��Ӧ֮һΪFe��6e-+8OH-=FeO42-+4H2O������X���ռ���784mL���壬��Y���ռ���112mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫����������___g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2���õ�����������ķ�Ӧ�ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W����Ԫ����Ԫ�����ڱ�������������ͬ�����ڵ�Ԫ�أ���ԭ��������������X��Wͬ���壬Y��ZΪͬ���ڵ�����Ԫ�ء�Wԭ�ӵ�����������Y��Zԭ������������֮�͡�Y���⻯���������3�����ۼ���Zԭ�������������Ǵ�����������3�������ƶϣ�
��1��X��Y��Z��W����Ԫ�صķ��ţ� X________��Y__________��Z____________��W��________
��2��������Ԫ���е�����Ԫ����ɵ�������ˮ��ˮ��Һ�Լ��ԵĻ�����ĵ���ʽ�ֱ�Ϊ__________________��______________________��
��3����X��Y��Z���γɵ����ӻ�������________________������W������������ˮ�����Ũ��Һ����ʱ��Ӧ�����ӷ���ʽ��________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ge)�ǵ��͵İ뵼��Ԫ�أ��ڵ��ӡ����ϵ�����Ӧ�ù㷺���ش��������⣺
(1)��̬Geԭ�ӵĺ�������Ų�ʽΪ[Ar]________����________��δ�ɶԵ��ӡ�
(2)�����ԭCO2�Ʊ�CH4��Ӧ�У���״����Zn2GeO4�Ǹ÷�Ӧ�����ô�����Zn��Ge��O�縺���ɴ���С��˳����________________��
(3)Ge�������н��ʯ�ͽṹ������Geԭ�ӵ��ӻ���ʽΪ________________________����֮����ڵ���������________________��
(4)��������������Ҫ�أ�
��ԭ�������������ʾ�����ڲ���ԭ�ӵ����λ�á���ͼΪGe�����ľ���������ԭ���������AΪ(0��0��0)��BΪ(![]() ��0��
��0��![]() )��CΪ(
)��CΪ(![]() ��
��![]() ��0)����Dԭ�ӵ��������Ϊ________��
��0)����Dԭ�ӵ��������Ϊ________��
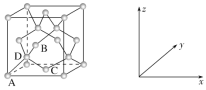
�ھ������������������Ĵ�С����״����֪Ge�����ľ�������a=565.76 pm�����ܶ�Ϊ________g��cm��3(�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ������ģ�8�ǻ�������㷺�����������ӵ���ϼ�����ȡ����Ҳ����Ҫ��ҽҩ�м��塣��ͼ��8�ǻ�����ĺϳ�·�ߡ�
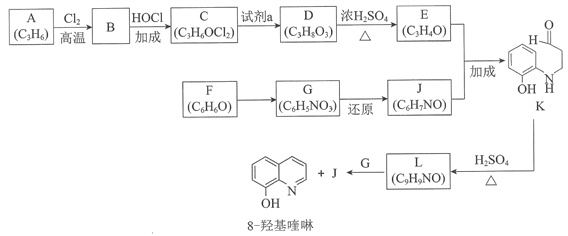
��֪��i. 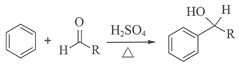
ii.ͬһ��̼ԭ��������2���ǻ��ķ��Ӳ��ȶ���
��1���������ŷ��࣬A�������__________��
��2��A��B�Ļ�ѧ����ʽ��____________________��
��3��C���ܵĽṹ��ʽ��__________��
��4��C��D������Լ�a��__________��
��5��D��E�Ļ�ѧ����ʽ��__________��
��6��F��G�ķ�Ӧ������__________��
��7��������K��L������ͼ����������____________

��8���ϳ�8�ǻ����ʱ��L������__________�����������ԭ������Ӧ����Ӧʱ��������ˮ����L��G���ʵ���֮��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߣ����л�ѧ�����У���ȷ����![]()
A.![]() �ĵ��뷽��ʽΪ
�ĵ��뷽��ʽΪ![]()
B.��AgCl�ı�����Һ�м�������Ũ![]() ��Һ����Һ�и�����Ũ�Ȳ���
��Һ����Һ�и�����Ũ�Ȳ���
C.�����£�![]() ��
��![]() �백ˮ�Ļ����Һ������Ũ�ȴ�С˳��
�백ˮ�Ļ����Һ������Ũ�ȴ�С˳��![]()
D.![]() ��ˮ�ⷴӦ���ӷ���ʽ��
��ˮ�ⷴӦ���ӷ���ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֪���볣���жϣ����й���SO2��Na2CO3��aq����Ӧ�����ӷ���ʽ����д�У����������ǣ� ��
�� | ���볣�� |
̼�� | K1��4��10��7 K2��5.6��10��11 |
������ | K1��1.54��10��2 K2��1.02��10��7 |
A.SO2��H2O��2CO32��=2HCO3����SO32��
B.SO2��H2O��CO32��=H2O+CO2��SO32��
C.2SO2��2H2O��CO32��=H2O+CO2��2HSO3��
D.SO2��H2O��CO32��=HCO3����HSO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ����ԭ�ϡ�
(1)�¹���ѧ�ҹ�����1902�꿪ʼ�о��ɵ���������ֱ�Ӻϳɰ���
��֪����![]() ��H=a kJ/mol
��H=a kJ/mol
��ÿ�ƻ�lmol�йػ�ѧ����Ҫ���������±���
H-H | N-H | N��N |
436kJ | 391kJ | 946k |
��a=_________________��
(2)��ͼΪ��ͬ�¶�(T)����ͬͶ�ϱ�[n(![]() )/n(
)/n(![]() )]ʱ��Ӧ�ﵽƽ��ʱ
)]ʱ��Ӧ�ﵽƽ��ʱ![]() ��ת���ʱ仯���ߡ�
��ת���ʱ仯���ߡ�
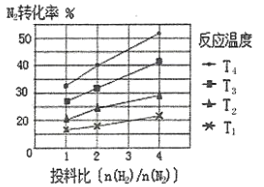
��![]() ��
��![]() ��
��![]() ��
��![]() �Ĵ�С��ϵΪ__________________��
�Ĵ�С��ϵΪ__________________��
�ڱ����¶Ⱥ�������䣬���Ͷ�ϱ�[n(![]() )/n(
)/n(![]() )]�������´ﵽƽ��ʱ������˵��һ����ȷ����_______(����ĸ���)��
)]�������´ﵽƽ��ʱ������˵��һ����ȷ����_______(����ĸ���)��
A.![]() ��Ũ������
��Ũ������
B.![]() ��ת��������
��ת��������
C.![]() �������������
�������������
D.![]() ��Ũ�ȼ�С
��Ũ�ȼ�С
���¶�Ϊ![]() ʱ����2L�ܱ������м���1.0mol
ʱ����2L�ܱ������м���1.0mol![]() ��1.0mol
��1.0mol![]() ����5min��Ӧ�ﵽƽ�⣬����v(
����5min��Ӧ�ﵽƽ�⣬����v(![]() )��ʾ�÷�Ӧ��ƽ������Ϊ____________________����Ӧ��
)��ʾ�÷�Ӧ��ƽ������Ϊ____________________����Ӧ��![]() ʱ��ƽ�ⳣ��K=________________��
ʱ��ƽ�ⳣ��K=________________��
(3)һ�����ͳ������е�������ķ����Dz���![]() ����ԭ����ԭ�����еĵ��������Ҳ�������Ⱦ��д��
����ԭ����ԭ�����еĵ��������Ҳ�������Ⱦ��д��![]() ��ԭ
��ԭ![]() �Ļ�ѧ��Ӧ����ʽ_____________________________________��
�Ļ�ѧ��Ӧ����ʽ_____________________________________��
(4)���ñ�����ⶨijϡ��ˮ��Ũ�ȣ�Ӧѡ��__________��ָʾ�����ζ��������۾�ע��_____________����֪ϡ��ˮ���Ϊ25.0mL���ζ������������0.0100mol/L�����ƽ�����Ϊ20.0mL����ð�ˮ��Ũ��Ϊ________________(����2λ��Ч����)�����ζ�ǰ�ζ��ܼ��������ݣ��ζ�����������ݣ���ⶨ���________(�ƫ����ƫС���������䡱)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com