
| A. | 氯化铵溶液呈酸性:NH4+═NH3+H+ | |
| B. | 氢硫酸的电离:H2S?2H++S2-? | |
| C. | 向小苏打溶液中加入醋酸溶液:HCO3-+H+?CO2+H2O | |
| D. | 在标准状况下,向10 mL 0.1 mol•L-1 FeBr2溶液中通入22.4 mL Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
分析 A.铵根离子在溶液中部分水解生成一水合氨和氢离子,溶液呈酸性;
B.氢硫酸为二元弱酸,其电离方程式需要分步书写,主要以第一步为主;
C.醋酸为弱酸,离子方程式中醋酸不能拆开,不能用可逆号,且没有用气体符号;
D.亚铁离子的还原性大于溴离子,亚铁离子优先被氧化,计算出亚铁离子、溴离子、氯气的物质的量,然后判断过量情况及反应产物.
解答 解:A.氯化铵溶液呈酸性的原因,是弱离子的水解,离子方程式为:NH4++H2O?NH3•H2O+H+,故A错误;
B.氢硫酸的电离分步进行,主要以第一步为主,其正确的电离方程式为:H2S?H++HS-,故B错误;
C.向小苏打溶液中加入醋酸溶液生成醋酸钠、二氧化碳气体和水,正确的离子方程式为:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-,故C错误;
D.10 mL 0.1 mol•L-1FeBr2溶液中含有0.001molFeBr2,含有0.001mol亚铁离子、0.002mol溴离子,标准状况下22.4mL氯气的物质的量为0.001mol,亚铁离子优先被氧化,0.001mol亚铁离子完全反应消耗0.0005mol氯气,剩余的0.0005mol氯气能够氧化0.001mol溴离子,则反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
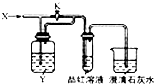 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | 2Al+2NaOH+6H2O=2NaAlO2+3H2↑ | D. | CaCO3=CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
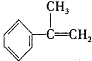 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式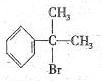 .
.
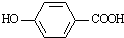 ),其反应类型为:消去反应;
),其反应类型为:消去反应;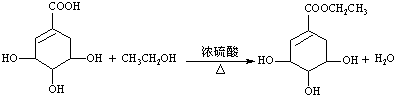 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②⑥ | C. | ⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 元素的单质可由氧化或还原含该元素的化合物来制得 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃的镁条在二氧化碳中继续燃烧 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 酸碱中和反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com