
砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是( )
A. 砷在通常状况下为固体
B. 砷的最高正化合价为+5
C. 砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强
D. 砷化氢(AsH3)不如氨气(NH3)稳定
考点: 元素周期律和元素周期表的综合应用.
专题: 元素周期律与元素周期表专题.
分析: A.氮、磷、砷的单质都属于分子晶体,熔点依次增大;
B.最高正化合价等于族序数;
C.同主族自上而下非金属性减弱,非金属性越强最高价含氧酸的酸性越强;
D.同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定.
解答: 解:A.氮、磷、砷的单质都属于分子晶体,熔点依次增大,砷在通常状态下是固体,故A正确;
B.砷为第四周期第ⅤA族元素,最高正化合价等于族序数,故砷的最高正化合价为+5,故B正确;
C.同主族自上而下非金属性减弱,非金属性越强最高价含氧酸的酸性越强,故酸性H3AsO4<H3PO4,故C错误;
D.同主族自上而下非金属性减弱,氢化物稳定性减弱,故AsH3不如NH3稳定,故D正确,
故选C.
点评: 本题考查了氮族元素的通性及递变规律,侧重考查学生对元素周期律的掌握,题目难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
下列溶液中 ,与100 ml
,与100 ml  0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
0.5 mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A、1 00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
00 ml 0.5 mol/L MgCl2 溶液 B、200 ml 0.25 mol/L CaCl2溶液
C、50  ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
ml 1 mol/L NaCl溶液 D、200 ml 0.25 mol/L HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
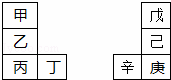
A. 金属性:甲>乙>丁
B. 原子半径:辛>戊>甲
C. 丙与庚的元素原子核外电子数相差13
D. 形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述中正确的是( )
A. 已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣802 kJ/mol,甲烷的燃烧热为802 kJ/mol
B. 等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多
C. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
D. 由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 石油的炼制过程都是化学变化过程
B. 石油分馏目的是将含碳原子数较多的烃先气化经冷凝而分离出来
C. 石油经过常、减压分馏、裂化等工序炼制后即能制得纯净物
D. 石油分馏出来的各馏分仍是多种烃的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 硫酸的摩尔质量是98g |
|
| B. | 2mol水的质量是18g/mol |
|
| C. | 氯化氢的摩尔质量等于它的相对分子质量 |
|
| D. | 22g二氧化碳的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 直径介于1~10 nm之间的粒子称为胶体 |
|
| B. | Fe(OH)3胶体是纯净物 |
|
| C. | 利用丁达尔效应可以区别溶液与胶体 |
|
| D. | 胶体粒子不可以透过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于离子键、共价键的各种叙述中,下列说法中正确的是( )
|
| A. | 在离子化合物里,只存在离子键,没有共价键 |
|
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 |
|
| C. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
|
| D. | 由不同元素组成的含多个原子的分子里,一定只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以硼镁矿(2Mg·B2O3·H2O·SiO2 )及少量Fe3O4、CaCO3、Al2O3 )为原料生产硼酸的工艺流程如下:
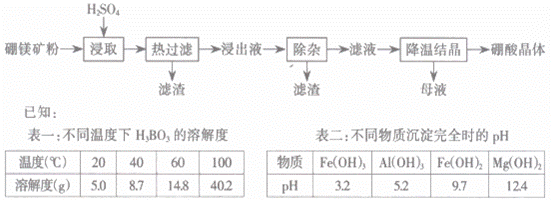
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_____。
(2) “浸出液”显酸性,含有H3BO3、Mg2+和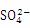 ,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2的作用为_________(用离子方程式表示)。
,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量目H2O2和MgO,可以除去的杂质离子为_________,H2O2的作用为_________(用离子方程式表示)。
(3) “浸取”后,采用“热过滤”的目的为_______。
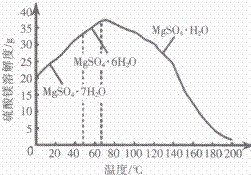
(4) “母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____。
(5)已知25 ℃时,硼酸( H3BO3)溶液中存在如下平衡:
H3BO3(aq)+H2O(l)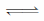 [B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10;
25℃时,0.7 mol·L-1硼酸溶液中c(H+)≈mol·L-1。
(6)已知25 ℃时:
| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是_____________(填选项字母)。
A.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
C.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
D.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com