
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
【答案】 3d64s2 分子 C![]() O
O ![]() O>C>Fe A、C γ 6 ρ=(224/a3·NA)×1030(或ρ=[4×56/a3·NA]×1030)
O>C>Fe A、C γ 6 ρ=(224/a3·NA)×1030(或ρ=[4×56/a3·NA]×1030)
【解析】(1)铁为26号元素,基态Fe原子的价电子排布式为3d64s2;Fe(CO)5的溶点-20℃,沸点103℃,熔沸点较低,Fe(CO)5晶体属于分子晶体,故答案为:3d64s2;分子;
(2) CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式为C≡O,与CO互为等电子体的分子有N2,故答案为:C≡O;N2;
(3)C、O、Fe三种元素的原子中铁的原子半径最大,Fe原子的价电子排布式为3d64s2,失去1个电子生成3d54s2,结构更稳定,第一电离能最小,C、O是同一周期元素,同一周期,从左到右,第一电离能逐渐增大,第一电离能由大到小的顺序为O>C> Fe,故答案为:O>C> Fe;
(4)A.根据Fe (CO)5的结构可知, Fe(CO)5为三角双锥结构,分子中正负电荷分布均匀,是非极性分子,CO中正负电荷分布不均匀,是极性分子,故A正确;B.Fe(CO)5中Fe原子与5个CO成键,不是sp3杂化,故B错误;C. 1molFe(CO)5 中Fe原子与5个CO形成5个配位键,在每个CO分子中存在1个配位键,共含有10mol配位键,故C正确;D. Fe(CO)5=Fe+5CO属于化学变化,包括化学键的断裂与形成,断开了分子中的配位键,形成了金属键,故D错误;故选AC;
(5)①根据晶胞结构图,三种晶体的晶胞中属于面心晶胞的是γ,故答案为:γ;
②α晶胞中晶胞顶点的铁原子与周围的6个铁原子距离相等且最小,配位数为6,故答案为:6;
③γ晶体晶胞的边长为a pm,1个晶胞中含有的铁原子数目=8×![]() +6×
+6×![]() =4,则γ-Fe单质的密度=
=4,则γ-Fe单质的密度=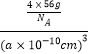 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】有机物的结构可用键线式简化表示,如![]() 可表示为
可表示为![]() ,有一种有机物X的键线式如图所示。
,有一种有机物X的键线式如图所示。
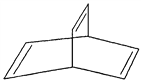
(1)X的分子式为________。
(2)有机物Y是X的同分异构体,且属于芳香族化合物。则Y的结构简式是________________。
(3)Y在一定条件下可发生反应生成高分子化合物,该反应类型属于_________________。
(4)Y可以与溴水反应,该反应的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能使品红溶液褪色的是( )
①干燥的Cl2 ②Na2O2 ③NaClO ④活性炭 ⑤SO2
A. 除①外其它都可以 B. 只有②③⑤ C. 只有①④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一定条件下,向A、B两个恒容密闭容器中分别加入等量的X(容器内所有物质均为气体),测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法正确的是
A. A.B容积相同,但反应温度不同.且温度:A>B
B. A、B反应温度相同,但容积不同,且容积:A>B
C. a,b,c三点对应的平均相对分子质量:b>c>a
D. t2-t3时间段内,A、B两容器中平均反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图1、2、3为三套实验装置。
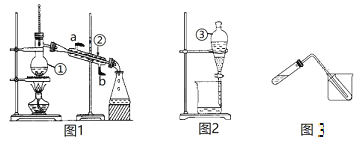
(1)图中所示仪器①和③的名称分别是_____________、_____________。
(2)图1装置可用于少量蒸馏水的制取,需要在仪器①中加入碎瓷片,目的是___________________;仪器②中冷却水的入口是__________(填“a”或“b”);图3装置也可用于少量蒸馏水的制取(加热及固定仪器略),该装置中使用的玻璃导管较长,其作用是____________。
(3)若用CCl4从碘水中萃取I2并用图2装置进行分离,振荡后静置观察到的现象是___________________________________________________________;在用图2装置进行分液操作时,为使液体顺利滴下,应进行的具体操作是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
香料E的合成路线如下:
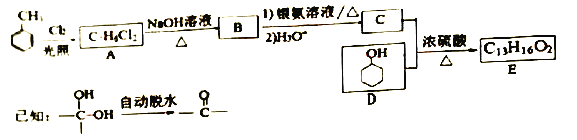
(l) B的化学名称是____。D中官能团的名称为_____。
(2)C和D生成E的反应类型为____.E的结构简式为______。
(3)1molB与足量银氨溶液反应生成____g Ag;A的核磁共振氢谱有_____个峰。
(4)同时满足下列条件的C的同分异构体有______种(不含立体异构)。
①遇FeC13溶液发生显色反应 ②能发生银镜反应
用D合成一种催眠药I的合成路线如下:
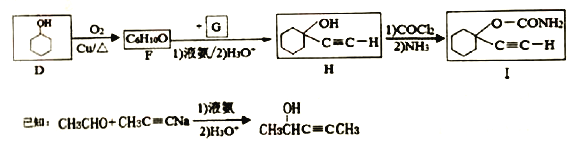
(5)D生成F的化学方程式为______________
(6)以乙炔和甲醛为起始原料。选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系.箭头上注明试剂和反应条件)__________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系.箭头上注明试剂和反应条件)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边溶液中同时各滴入几滴酚酞溶液,请回答以下问题:
①X极上的电极反应式是______________________________________________________。
②电解NaCl溶液的离子方程式是____________________________________________。
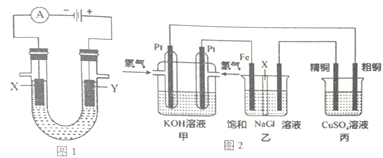
(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为______________________________________________________________。
②石墨电极(乙装置中右侧电极)为__________极(填“阳”或“阴”),反应一段时间后,在乙装置中滴入酚酞溶液,__________极区(填“铁”或“石墨”)的溶液变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”、“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为__________L;丙装置中阴极析出铜的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的能量图,下列说法正确的是
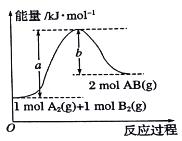
A. A2(g)+B2(g)=2AB(g)是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 1molA2(g)和1molB2(g)的能量之和为akJ
D. 2AB(g)=A2(l)+B2(l)△H<(b-a)kJ/mo1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com