
火力发电厂释放出大量氮氧化物(NOx)、二氧化硫和二氧化碳等气体而造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) △H1= -574 kJ/mol
CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) △H2= -1 160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为______________________
(2)脱碳。将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H3
CH3OH(g) +H2O(g) △H3
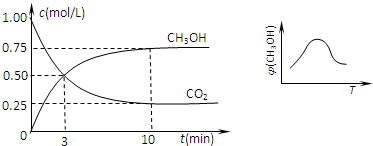
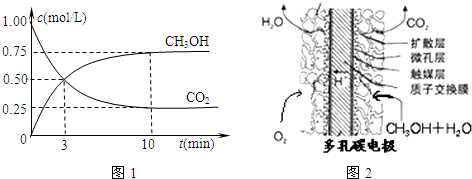
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图甲所示,则上述CO2转化为甲醇反应的△H3____(填 “>”“<”或“=”)0。


科目:高中化学 来源: 题型:
| 起始物质的量/mol | 甲 | 乙 | 丙 |
| n(H2O) | 0.10 | 0.20 | 0.20 |
| n(CO) | 0.10 | 0.10 | 0.20 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.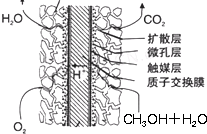
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 16 |
| 3 |
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 3 |
| 16 |
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com