
| A、2种 | B、4种 | C、8种 | D、14种 |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加并振荡 | 溶液变红色 | |
| 2 | 取所述黄色溶液于试管中,滴加并振荡 | (同上) | |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40 | B、48 | C、41 | D、49 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
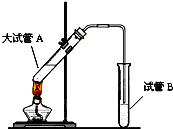 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
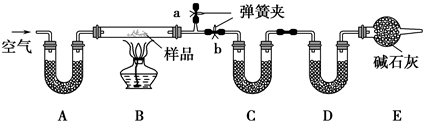
查看答案和解析>>
科目:高中化学 来源: 题型:
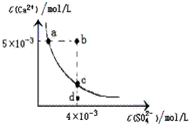
| A、CaSO4在稀硫酸中的溶解性比在纯水中的溶解性 强 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等 于3×10-3 mol/L |
| C、d点溶液通过蒸可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | ||
| B、0.1mol/LH2SO4与0.1mol/L氨水等体积混合:c(H+)>c(NH4+)>c(SO42-)>c(OH-) | ||
C、0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:
| ||
| D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com