
| 反应时间/min | n(SO2)/mol | n(NO2)/mol |
| 0 | 2.40 | 1.20 |
| 4 | 1.60 | |
| 8 | 0.40 |
| △c |
| △t |
| ||
| 4min |
| 0.8×0.8 |
| 1.6×0.4 |
| 0.9×0.8 |
| 1.6×0.5 |
| 0.8×0.8 |
| 1.6×0.4 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、洗气或干燥装置:瓶内放一定体积溶液,由a进气 |
| B、用于收集氢气:瓶内充满水,由b进气 |
| C、排空气收集H2:瓶内充满空气,由a进气 |
| D、病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是非氧化还原反应 |
| B、在理论上可以利用该反应的原理做成燃料电池 |
| C、该反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=2 165 kJ?mol-1 |
| D、每生成18 g水,该反应转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4 |
| B、Na2CO3 |
| C、KNO3 |
| D、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
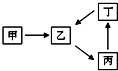 甲、乙、丙、丁四种物质转化关系如图.已知甲是地壳中含量最高的元素组成的单质.
甲、乙、丙、丁四种物质转化关系如图.已知甲是地壳中含量最高的元素组成的单质.| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com