
| A、稀释溶液,水解程度减小 | ||||||
| B、通入CO2,平衡朝正反应方向移动 | ||||||
C、升高温度,
| ||||||
| D、加入NaOH固体,溶液PH减小 |
c(HC
| ||
c(C
|


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| A、减压 | B、升温 |
| C、加入合适的催化剂 | D、增大B的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在25℃和80℃时纯水中的c[H+]浓度 |
| B、室温时,浓度均为 0.1 mol?L-1的 (NH4)2SO4(aq)、(NH4)2CO3(aq)的 c (NH4+) |
| C、相同条件下,0.l mol?L-1 NaHCO3和 0.1 mol?L-1Na2CO3溶液的 pH |
| D、1 L饱和CH3COONa溶液中CH3COO-和Na+的个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
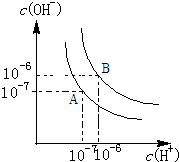 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中导电粒子的数目增加,导电性增强 | ||
| B、醋酸的电离程度增大,c(H+)亦增大 | ||
| C、再加入10mLpH=11NaOH溶液,混合液pH=7 | ||
D、溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com