
| A. | ③④⑤⑦ | B. | ①③④⑦ | C. | ②③④⑤⑦ | D. | ②④⑤⑦ |
分析 ①根据没有告诉是标准状况下判断;
②根据乙烯和丙烯的实验式计算出混合气体中含有的实验式的物质的量;
③根据电子守恒计算出阴极生成铜的质量;
④根据标况下的气体摩尔体积计算出空气中含有的分子数;
⑤根据过氧化钠中氧元素为-1价分析生成氧气的物质的量及质量;
⑥根据氢氧化铁胶体是氢氧化铁的聚集体判断;
⑦根据碳酸钠溶液中碳酸根离子水解生成氢氧根离子分析.
解答 解:①没有告诉是标准状况下,题中条件无法计算氨气的物质的量,故①错误;
②乙烯和丙烯的最简式为CH2,1.4g混合气体中含有0.1mol实验式,含有0.1mol碳原子,含有0.1NA个碳原子,故②错误;
③精炼铜,若阳极失去2NA个电子,阴极铜离子得到2mol电子生成1mol铜,则阴极增重64g,故③正确;
④标准状况下,22.4L空气的物质的量为1mol,含有NA个分子,故④正确;
⑤过氧化钠与水反应,若电子转移2NA,转移了2mol电子,能够生成1mol氧气,则产生的氧气为32g,故⑤正确;
⑥将1L 2mol/L 的FeCl3溶液加入到沸水中,加热使之完全反应,由于氢氧化铁胶体是氢氧化铁的聚集体,无法计算含有的胶体粒子数,故⑥错误;
⑦在1L 0.1mol/L的碳酸钠溶液中,含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,导致溶液中阴离子数目增多,所以溶液中阴离子总数大于0.1NA,故⑦正确;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 被保护的金属与电源的正极相连 | |
| B. | 被保护的金属表面上不发生氧化反应,也不发生还原反应 | |
| C. | 在被保护的金属表面上发生氧化反应 | |
| D. | 被保护的金属与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电过程中KOH的物质的量浓度不变 | |
| B. | 负极反应为14H2O+7O2+28e-=28OH- | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化天然气(LNG)和罐装液化石油气(LPG)主要成分都属于烃类 | |
| B. | 煤经过干馏可以得到焦炭和煤焦油等产品,分馏煤焦油可以获得多种芳香烃 | |
| C. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 | |
| D. | 石油的分馏、煤的液化、煤的气化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
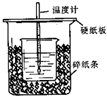 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸显深蓝色的溶液:Na+、K+、I-、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1的Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加KSCN显红色的溶液:Na+、Mg2+、I-、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
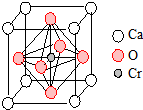 重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com