
���� ��1��CH4�ڸ��¡�������������ˮ������Ӧ�ķ���ʽΪCH4��g��+2H2O��g��=CO2��g��+4H2��g��������2mol CO2����316kJ��������1molCH4���ӷ�Ӧʱ��Ҫ���յ�����Ϊ158kJ��CO2��K2CO3��Һ��Ӧ����̼�����Ƽأ��ݴ˴��⣻
��2��������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ��������ĺ�����С��
��A��Kֻ���¶�Ӱ�죬�¶Ȳ���ƽ�ⳣ�����䣬����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��
B���Ӵ����ܼӿ췴Ӧ���ʵ�ƽ�ⲻ�ƶ���
C����ͬѹǿ�£�Ͷ����ͬ���¶�Խ�߷�Ӧ����Խ�죬�ﵽƽ������ʱ��Խ�̣�
D���÷�ӦΪ���淴Ӧ����Ӧ��ת���ʲ����ܴﵽ100%��
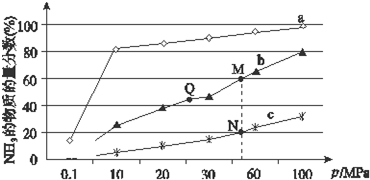
�۸��ݷ�ӦN2��g��+3H2��g��?2NH3��g����������ʽ�����ƽ��ʱ�����ʵ�Ũ�ȣ�������ƽ�ⳣ����
��3�����ɵ�����Ⱦ������Ϊ���������ݵ��ԭ��д�������缫��Ӧʽ��
��4����Ӧ6NO2+8NH3 $\frac{\underline{\;����\;}}{��}$7N2+12H2O����ʽ��֪6NO2��24mole-���Դ������
��� �⣺��1��CH4�ڸ��¡�������������ˮ������Ӧ�ķ���ʽΪCH4��g��+2H2O��g��=CO2��g��+4H2��g��������2mol CO2����316kJ��������1molCH4���ӷ�Ӧʱ��Ҫ���յ�����Ϊ158kJ�����Է�Ӧ���Ȼ�ѧ����ʽ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+158kJ/mol��CO2��K2CO3��Һ��Ӧ����̼�����Ƽأ���Ӧ�����ӷ���ʽΪCO32-+CO2+H2O=2HCO3-��
�ʴ�Ϊ��CH4��g��+2H2O��g��=CO2��g��+4H2��g����H=+158kJ/mol��CO32-+CO2+H2O=2HCO3-��
��2���ٺϳɰ��ķ�ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ�ߣ�Խ�����ڷ�Ӧ������У�����a�İ��������ʵ���������ߣ��䷴Ӧ�¶ȶ�Ӧ�����ͣ�����a���߶�Ӧ�¶�Ϊ200��C��
�ʴ�Ϊ��200�棻
��A��Kֻ���¶�Ӱ�죬�¶Ȳ���ƽ�ⳣ�����䣬����K��M��=K��Q��������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��Q����¶ȵ���N������K��Q����K��N������A��ȷ��
B���Ӵ����ܼӿ췴Ӧ���ʵ�ƽ�ⲻ�ƶ�������H2��ƽ��ת���ʲ��䣬��B��ȷ��
C����ͬѹǿ�£�Ͷ����ͬ���¶�Խ�߷�Ӧ����Խ�죬�ﵽƽ������ʱ��Խ�̣�cba���¶����ν��ͣ����Դﵽƽ������ʱ���ϵΪa��b��c����C����
D���÷�ӦΪ���淴Ӧ����Ӧ��ת���ʲ����ܴﵽ100%����D����
��ѡ��AB��
��N��ʱ�������ʵ����ķ���Ϊ20%����������ʽ����N2ת������b��N2����ʼŨ��Ϊa��
���ݷ�ӦN2��g��+3H2��g��?2NH3��g��
��ʼ a 3a 0
ת�� ab 3ab 2ab
ƽ�� a-ab 3a-3ab 2ab
����������$\frac{2ab}{a-ab+3a-3ab+2ab}$=20%��2ab=0.2mol-1������a=0.3mol•L-1��b=$\frac{1}{3}$������ƽ�ⳣ��K=$\frac{��2ab��^{2}}{��a-ab������3a-3ab��^{3}}$=$\frac{25}{27}$=0.926��
�ʴ�Ϊ��0.926��
��3�����õ�ⷨ��NH3•H2Oת��Ϊ�Ի�������Ⱦ������Ϊ����������ʧȥ���ӷ���������Ӧ���缫��ӦʽΪ��2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
��4����Ӧ6NO2+8NH3 $\frac{\underline{\;����\;}}{��}$7N2+12H2O���ɷ���ʽ��֪6NO2�μӷ�Ӧת��24mole-���������ĵ�NO2�ڱ�״���µ������$\frac{0.6}{24}$��6��22.4L=3.36L��
�ʴ�Ϊ��3.36��
���� ���⿼�����Ȼ�ѧ����ʽ����д����ѧƽ��ļ��㡢����ԭ����������ԭ��Ӧ�ļ���ȣ���Ŀ�Ѷ��еȣ�ע����������ʽ���л�ѧƽ��ļ��㣬��ȷ��Ӧ���ʵĸ�����㷽��������������ѧ���ķ�����������������ѧ����������


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KMnO4 | B�� | NH3•H2O | C�� | HNO3 | D�� | H2O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | NaOH��Һ������������� | B�� | ��������������� | ||
| C�� | ����Ӧ��ת�Ƶĵ�������� | D�� | ��Ӧ������Һ��pH��С��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ�ӵ�Ħ��������aNA | |
| B�� | mg��ԭ���к���aNA��ԭ�� | |
| C�� | mg��ԭ�ӵ����ʵ���һ����$\frac{m}{a{N}_{A}}$mol | |
| D�� | �����ӵ�����NA=$\frac{12}{��}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | T���棩 | NO��ʼŨ�ȣ�mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
| �� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
| �� | 280 | a | 5.80��10-3 | 124 |
| �� | 350 | 1.20��10-3 | 5.80��10-3 | b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| �¶�/�� | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| ʵ�� ��� | ͭƬ ����/g | 0.1mol•L-1 ����/mL | ����ͭ ��Һ/mL | �������� ��Һ/mL | ˮ����� /mL | ʵ��Ŀ�� |
| �� | 5 | 20 | 0 | 0 | 0.5 | ʵ��ٺ͢�̽��Cu2+��ʵ���Ӱ�죻ʵ��ٺ͢�̽�����������Ӱ�죮 |
| �� | 5 | 20 | 0.5 | 0 | 0 | |
| �� | 5 | 20 | 0 | X | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ�����⾫�������� | B�� | ����ɫ��Ⱦɫ����ͷ | ||
| C�� | ������ͭ���ݹ���Ҷ������ | D�� | ��ʳ��ˮ���ݹ��IJ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �����ͽṹ��ͼ������һ���������ܷ����ķ�Ӧ�У���������
�����ͽṹ��ͼ������һ���������ܷ����ķ�Ӧ�У���������| A�� | �٢ڢ� | B�� | �٢ڢ� | C�� | �ܢݢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ���� | ���� |
| A | �ֱ����Na2CO3��NaHCO3���� | �Թ��ڱڶ���ˮ�� | �������ʾ� ���ȷֽ� |
| B | ��FeSO4��Һ���ȵ���KSCN��Һ�ٵμ�H2O2��Һ | ����H2O2����Һ���Ѫ��ɫ | Fe2+�������������л�ԭ�� |
| C | ��Ư���е���ϡ���ᣬ�����ɵ�����ͨ��Ʒ����Һ | Ʒ����Һ��ɫ | �����к���Cl2 |
| D | ��I-����ɫ��Һ�еμ�����������ˮ���ٵμӵ�����Һ | ������ۺ���Һ�����ɫ | ��ԭ�ԣ�Cl-��I- |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com