
【题目】(1)某气体的摩尔质量为M g·mol-1,分子数目为N,质量是m g,阿伏加德罗常数为NA,m(C)为12C原子质量,试说明下列各式所表示的意义。
①![]() ________________________________。
________________________________。
②![]() _______________________________。
_______________________________。
③![]() ___________________________________。
___________________________________。
④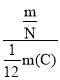 _____________________。
_____________________。
(2)下列气体在同温度、同体积、同质量时,压强最大的是(_______________)
A.CO2 B.CO C.CH4 D.H2
科目:高中化学 来源: 题型:
【题目】(1)标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下 1mol 某纯物质的热效应,单位常用 kJ/mol表示,已知在 25℃的条件下:
①Ag2O(s)+2HCl(g)═2AgCl(s)+H2O(l)△H=-324.4 kJ/mol
②2Ag(s)+ ![]() O2(g)═Ag2O(s)△H=-30.56kJ/mol
O2(g)═Ag2O(s)△H=-30.56kJ/mol
③ ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H=-92.21 kJ/mol
Cl2(g)═HCl(g)△H=-92.21 kJ/mol
④H2(g)+ ![]() O2(g)═H2O(l)△H=-285.6 kJ/mol
O2(g)═H2O(l)△H=-285.6 kJ/mol
则25℃时氯化银的标准生成热为________ kJ/mol;
(2)实验测得 64g 甲醇[CH3OH(l)]在氧气中充分燃烧生成 CO2 气体和液态水时放出 1452.8kJ 的热量,则表示甲醇燃烧热的热化学方程式_________________;
(3)以甲烷、氧气为原料,KOH 为电解质,构成燃料电池,写出其负极的电极反应式:________;
(4)电解法制取有广泛用途的 Na2FeO4,工作原理如下图所示。
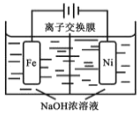
已知:Na2FeO4 只在强碱性条件下稳定。
①Na2FeO4能够净水的主要原因是_______________ 。
②阳极电极反应式 _______________;
③为使电解能较持久进行,应选用_______________ 离子交换膜(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A.3g3He含有的中子数为NA
B.22gCO2与标准状况下11.2 L HF含有相同分子数
C.1 molK2Cr2O7被还原为Cr3+转移的电子数为6NA
D.在25℃、1.01×105 Pa的条件下,2.24LH2中含有的分子数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图所示,下列说法中正确的是( )

A.分子式为C17H18O3
B.M中所有碳原子均可能在同一平面
C.1mol M最多可以与3 mol NaOH反应
D.M可以发生加成、取代、消去等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
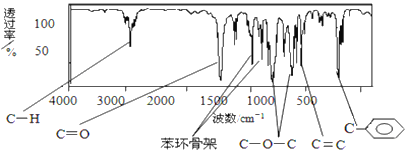
【题目】(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如图:则肉桂酸甲酯的结构简式是 _______(不考虑立体异构)。
(2)有机玻璃聚丙烯酸甲酯的结构简式为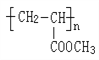 ,写出其单体____________;若聚合度n为3000,求有机玻璃的相对分子质量为________;
,写出其单体____________;若聚合度n为3000,求有机玻璃的相对分子质量为________;
(3)制备酚醛树脂的化学反应方程式:_________________________________;
(4)![]() 与足量NaOH溶液的反应方程式:
与足量NaOH溶液的反应方程式:
______________________________________________________________。
(5) 发生反应生成八元环状物质的反应方程式:
发生反应生成八元环状物质的反应方程式:
_______________________________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
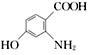
【题目】咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中。咖啡酸有止血作用。下列关于咖啡酸的说法不正确的是
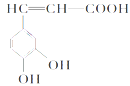
A.咖啡酸的分子式为C9H8O4
B.1 mol咖啡酸可以和含4 molBr2的浓溴水反应
C.1 mol咖啡酸与足量NaHCO3溶液反应能产生标况下约67.2L的CO2
D.不可以用高锰酸钾检验咖啡酸分子中的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
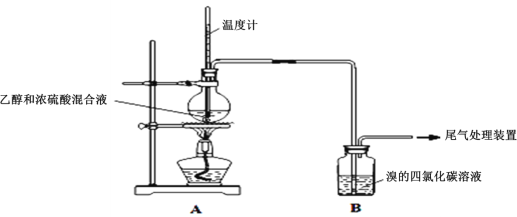
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
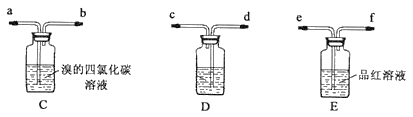
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
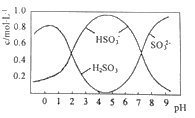
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应的应用比较广泛。阅读下面的材料,结合相关化学知识回答下列问题。黑火药主要是硝酸钾、硫磺、木炭三者粉末的混合物,在点燃条件下,其化学反应式主要为:2KNO3+S+3C=N2↑+3CO2↑+K2S
(1)在黑火药燃烧的反应中,氧化剂为___;
(2)该反应被氧化的元素是___;
(3)该反应的氧化产物是___;
(4)KNO3中N元素的化合价是___;
(5)根据化学反应式分析,一个硫原子参与反应时转移___个电子;
(6)把Cl2通入浓氨水中,发生如下反应:3Cl2+8NH3=6NH4Cl+N2。用双线桥表示反应的电子转移方向和数目:___。
(7)已知存在下列反应:①ClO3-+5Cl-+6H+ =3Cl2+3H2O ②2Fe2++Cl2=2Fe3++2 Cl-。则ClO3-、Fe3+、Cl2三种微粒氧化能力由强到弱的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1molL﹣1的H2A(二元弱酸)溶液中滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是
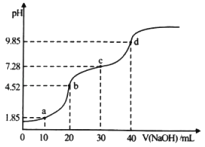
A.a点的溶液中:c(Na+)>c(A2)>c(HA)>c(H+)>c(OH)
B.b点的溶液中:c(H2A)+c(H+)=c(A2)+c(OH)
C.c点溶液的pH>7,是因为此时HA的电离能力小于其水解能力
D.若将0.1molL﹣1的NaOH溶液换成同浓度的氨水,当滴加40mL时,此时溶液的pH>9.85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com