
| A. | 20.7% | B. | 22% | C. | 1.3% | D. | 7.3% |
分析 根据化学式的组成可将三种物质表示为C2H2和C6H6和CH.HO二种物质,则先利用碳的质量分数为72%计算氢的质量分数,存在固定组成HO,然后计算其中含氧的质量分数,最后计算出混合物中氢元素的质量分数.
解答 解:CH2O可以表示为CH•HO,故乙炔(C2H2)、苯(C6H6)和甲醛(CH2O)的混合物可看做是C2H2和C6H6和CH•HO的混合物,有三种物质的化学式可知最简式为CH,进一步可以看做是CH•HO的混合物,碳元素的质量分数为72%,则CH的质量分数为:$\frac{72%}{\frac{12}{13}}$=78%,故HO的质量分数为:1-78%=22%,
故氧元素的质量分数为:22%×$\frac{16}{17}$=20.7%,
所以H元素的质量分数为:1-20.7%-72%=7.3%,
故选D.
点评 本题考查混合物中元素质量分数的计算,题目难度中等,关键是根据甲醛的化学式将物质转化为最简式为CH与HO的混合物,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
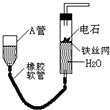 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl2不存在同分异构体是甲烷正四面体结构的理由之一 | |
| B. | 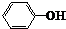 和 和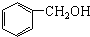 互为同系物 互为同系物 | |
| C. |  的系统命名的名称是1,2-二溴-2-环己烯 的系统命名的名称是1,2-二溴-2-环己烯 | |
| D. | 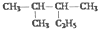 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的比例模型是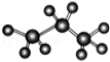 | |
| B. | C2H4 与C3H6一定互为同系物 | |
| C. | 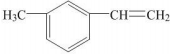 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为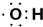 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
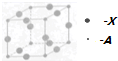 A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.
A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com