
【题目】在耐高温的淀粉酶运用到工业生产前,需对该酶的最佳温度范围进行测定。如图中的曲线①表示酶在各种温度下,酶活性相对最高酶活性的百分比。将酶在不同温度下保温足够长的时间,再在酶活性最高的温度下测其残余酶活性,由此得到的数据为酶的热稳定性数据,即图中的曲线②。据图判断,下列叙述错误的是

A.该酶只能在最佳温度范围内测出活性
B.曲线②35℃数据点是在80℃时测得的
C.曲线①表明80℃是该酶活性最高的温度
D.该酶使用的最佳温度范围是:60~70℃
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,a mol气体A分子与b mol气体B分子的质量相同.则与此有关的下列说法中正确的是( )
A.A与B的摩尔质量之比为a:b
B.相同状况下,同体积的A与B的质量之比为a:b
C.质量相同的A与B的体积之比为b:a
D.同温同压下,A与B的密度之比为b:a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)[探究一]将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应选用(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
(3)[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略). 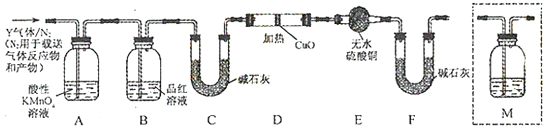
装置B中试剂的作用是 .
(4)认为气体Y中还含有Q的理由是(用化学方程式表示).
(5)为确认Q的存在,需在装置中添加M于(选填序号).
a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有H2 , 预计实验现象应是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一个土豆(含有过氧化氢酶)切成大小和厚薄相同的若干片,放入盛有一定体积和浓度的过氧化氢溶液的针筒中(如右图所示)。若土豆片为4片时,在温度为15℃的条件下,每隔5分钟收集一次数据,并绘制出如图曲线1。利用同样的实验装置,改变某一种条件后,收集数据可绘制出曲线2。则改变的条件是

A. 降低过氧化氢溶液的浓度 B. 增加土豆片的数量
C. 将温度提高到25℃ D. 将针筒换成容积更大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁、铜及其化合物的说法正确的是
A. FeSO4 可用于生产缺铁性贫血的药剂
B. 硫酸铜常用于饮用水的消毒剂
C. 常温下铁与浓硫酸不反应
D. 铁丝不能代替铂丝来做焰色反应实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓硫酸中H2SO4的物质的量浓度为 mol/L.
(2)取用任意体积的该硫酸溶液时,下列物理量中不随所取硫酸分子式:H2SO4相对分子量:98密度1.2g/mLH2SO4多少而变化的是 .
A.溶液中H2SO4的物质的量
B.溶液的浓度
C.溶液中H+的数目
D.溶液的密度
(3)某学生欲用上述浓硫酸和蒸馏水配制500mL物质的量浓度为0.3mol/L硫酸.
①该学生需要量取 mL上述浓硫酸进行配制.
②配制过程中,需要使用的仪器是(填写代号) .
A.烧杯 B.量筒 C.1000mL容量瓶 D.托盘天平
E.药匙 F.500mL容量瓶 G.胶头滴管 H.玻璃棒
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓硫酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的硫酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1﹣2cm处
④在配制过程中,下列实验操作会使所配制的稀硫酸的物质的量浓度偏高的是 .
A.用量筒量取浓硫酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀硫酸润洗容量瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4.在调节溶液pH值时,应选用的试剂是( )
A.NaOH
B.ZnO
C.Zn
D.Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com