
| A. | 氨极易溶于水 | B. | 铵离子不能独立存在 | ||
| C. | 常温下氨是气态物质 | D. | 氮原子不能形成阳离子 |
分析 A、氨极易溶于水是因为氨分子与水分子之间存在氢键;
B、铵离子不能独立存在与分子晶体无关;
C、氨的沸点低,说明分子间作用力小;
D、氮原子能否形成阳离子与晶体类型无关.
解答 解:A、氨极易溶于水是因为氨分子与水分子之间存在氢键,氨本身晶体类型无关,故A错误;
B、铵离子不能独立存在与分子晶体无关,所以不支持固态氨是分子晶体的事实,故B错误;
C、氨的沸点低,说明分子间作用力小,支持固态氨是分子晶体的事实,故C正确;
D、氮原子能否形成阳离子与晶体类型无关,所以不支持固态氨是分子晶体的事实,故D错误;
故选C.
点评 本题考查分子晶体的性质、判断等,比较基础,注意基础知识的掌握与理解.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
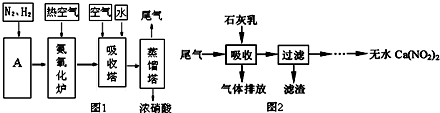
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液,出现红色,一定不含Fe2+ | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| D. | 玻璃、水泥、陶瓷、刚玉都是硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
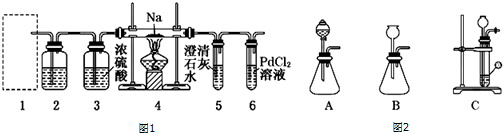
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
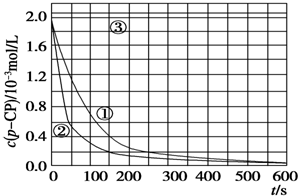 [数据处理]
[数据处理]查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01g | B. | 0.02g | C. | 0.14g | D. | 0.17g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| A | Cl2 | SO2 | Ba(NO3)2 |
| B | HCl | CO2 | 石灰水 |
| C | NH3 | SO2 | Ba(OH)2 |
| D | NO2 | SO2 | BaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com