
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.分析 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,据此答题.
解答 解:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,所以X为铜,Y为氯,Z为氧,W为硫,
(1)①元素Y为Cl,Cl有3个电子层,最外层7个电子,故处于周期表中第三周期第ⅦA族,元素X为Cu,处于周期表中ds区,
故答案为:三;ⅦA;ds;
②O所在周期为第二周期,其中第一电离能最大的元素是氖,
故答案为:氖;
③X为Cu,Cu的原子序数为29,为第四周期第ⅠB族元素,Cu+的核外电子排布式为:1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
④Cl和S两元素所形成的最高价氧化物对应的水化物分别为H2SO4和HClO4,元素的非金属性越强,其最高价氧化物水化物的酸性越强,由于非金属性Cl>S,故酸性较强的是HClO4,
故答案为:HClO4;
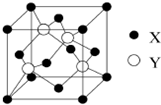
(2)①Cu与Cl所形成化合物晶体的晶胞如图所示,1个晶胞中Cu为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:4;
②Cl为:4,故此晶胞中Cu与Cl的个数比为1:1,故化学式为:CuCl,
故答案为:CuCl;
(3)Cu与浓硫酸加热条件下生成硫酸铜、二氧化硫气体和水,化学反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
点评 本题主要考查的是元素的推断以及元素周期律的应用,涉及元素位置推断、离子核外电子排布式书写、化学反应方程式书写等,题目难度中等,属于常考题类型,平时学习应注意总结归纳.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五氧化二磷只是磷酸的酸酐 | |
| B. | 二氧化氮不是硝酸的酸酐 | |
| C. | 安全火柴盒的侧面所涂的物质是一种混合物,其中含有红磷和三硫化二锑等 | |
| D. | 含磷的废水拍到自然水中,能引起藻类增殖,使水变质,必须除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将久置的亚硫酸钠溶液中加入氯化钡溶液再加入稀盐酸 | |
| B. | 向碳酸钠溶液中加入酸性氯化钙溶液 | |
| C. | 向亚硫酸钠溶液中通入氯气再加入氯化钡和稀盐酸 | |
| D. | 向亚硫酸钠溶液中加入稀硝酸后再加入氯化钡溶液 | |
| E. | 二氧化硫通入氯化钡溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com