
【题目】合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应C(s)+CO2(g)2CO(g) ΔH,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
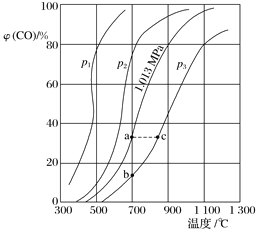
(1)p1、p2、p3的大小关系是_______,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为___________________。图中a、b、c三点对应的平衡常数(用Ka、Kb和Kc表示)大小关系是____________________;
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为__________,该反应的平衡常数K=________________。
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.101 3 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?_________________,二者之间有何关系?__________________。
(4)CO2催化加氢也可转化为CO,但同时会合成二甲醚,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
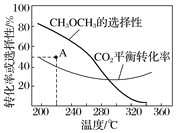
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图
其中:CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是___________;
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________________。
(5)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
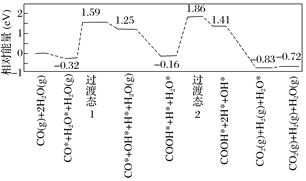
可知水煤气变换的ΔH_______0(填“大于”、“等于”或“小于”)。该历程中最大能垒(活化能)E正=_______eV,写出该步骤的化学方程式____________________。
【答案】p1<p2<p3 升高温度、减小压强 Ka=Kb<Kc 66.7% ![]() 正反应和逆反应速率均减小 v(正)<v(逆) 反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度 增大压强、使用对反应Ⅱ催化活性更高的催化剂 小于 2.02 COOH*+H*+H2O*=COOH*+2H*+OH*
正反应和逆反应速率均减小 v(正)<v(逆) 反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度 增大压强、使用对反应Ⅱ催化活性更高的催化剂 小于 2.02 COOH*+H*+H2O*=COOH*+2H*+OH*
【解析】
(1)反应C(s)+CO2(g)2CO(g)是气体分子数增多的反应,随着反应进行,体系压强增大,减小压强有助于化学平衡正向移动,化学平衡常数只随温度的改变而改变;
(2)900℃、1.013MPa时,平衡时CO的体积分数为80%,计算CO2转化的量,转化率就是转化的量与起始量比值的百分数,将各组分的平衡浓度代入平衡常数表达式计算化学平衡常数;
(3)根据改变条件前后CO2的体积分数的变化判断,根据浓度商判断化学反应的方向;
(4)①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是:反应Ⅰ的△H>0,反应Ⅱ的△H<0,升温反应Ⅰ正向进行,反应Ⅱ逆向进行;
②不改变反应时间和温度,一定能提高CH3OCH3选择性的条件,结合催化剂的选择性分析;
(5)图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,正反应是放热的,结合图示分析判断,该历程中最大能垒(活化能)E正,得到反应的化学方程式。
(1)反应C(s)+CO2(g)2CO(g)是气体分子数增多的反应,随着反应的进行,体系压强增大,减小压强有助于化学平衡正向移动,表明低压强对应着高的CO体积分数,则p1、p2、p3的大小关系是:p1<p2<p3;当压强相同时,温度升高,CO的体积分数增大,表明温度升高化学平衡正向移动,正反应为吸热反应,焓变△H>0,则欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为:升高温度、降低压强;化学平衡常数只随温度的改变而改变,升高温度,正反应趋势增大,化学平衡常数增大,则a、b、c三点对应的平衡常数大小关系是:Ka=Kb<Kc,故答案为:p1<p2<p3;升高温度、降低压强;Ka=Kb<Kc;
(2)900℃、1.013MPa时,设反应转化的CO2的物质的量为xmol,则平衡时n(CO)=2x,n(CO2)=1-x,平衡时CO的体积分数为80%,则![]() ×100%=80%,解得:x=
×100%=80%,解得:x=![]() ,则CO2的转化率为α=
,则CO2的转化率为α=![]() ×100%=66.7%;平衡时,c(CO)=
×100%=66.7%;平衡时,c(CO)=![]() =
=![]() ,c(CO2)=
,c(CO2)=![]() =
=![]() ,则该反应的平衡常数K=
,则该反应的平衡常数K=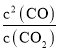 =
=![]() ,故答案为:66.7%;
,故答案为:66.7%;![]() ;
;
(3)反应C(s)+CO2(g)2CO(g)是气体分子数增大的吸热反应,降低压强,升高温度均有利于反应正向进行,将(2)中平衡体系温度降至640℃,压强降至0.1013 MPa,降低温度、减小压强,使正、逆反应速率均减小,重新达到平衡后CO2的体积分数为50%,设反应转化的CO2的物质的量为ymol,则平衡时n(CO2)=1-y,n(CO)=2y,则有![]() =50%,可得y=
=50%,可得y=![]() ,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,化学平衡向逆反应方向移动,所以v(正)<v(逆),故答案为:正反应和逆反应速率均减小;v(正)<v(逆);
,可见重新达到平衡时,体系中CO含量降低,CO2含量升高,化学平衡向逆反应方向移动,所以v(正)<v(逆),故答案为:正反应和逆反应速率均减小;v(正)<v(逆);
(4)①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是:反应Ⅰ的△H>0,反应Ⅱ的△H<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度,故答案为:反应Ⅰ的△H>0,反应Ⅱ的△H<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度;
②反应Ⅰ是反应前后气体体积不变的反应,压强对其无影响,反应Ⅱ是2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g),增大压强,利于反应正向进行,可以提高二甲醚的选择性。两个竞争反应的存在,可以利用催化剂的选择性,选择合适的催化剂,提高二甲醚的选择性,故答案为:增大压强、使用对反应Ⅱ催化活性更高的催化剂;
(5)图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,反应的焓变小于0,结合图示分析判断,发生的过渡反应:COOH*+H*+H2O*=COOH*+2H*+OH*,该历程中能垒(活化能)最大,为E正=1.86eV-(-0.16eV)=2.02eV,故答案为:小于;2.02;COOH*+H*+H2O*=COOH*+2H*+OH*。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学
B.凡是含有碳元素的化合物都属于有机化合物
C.有机物都是从有机体中分离出的物质
D.根据分子中碳原子是连成链状还是环状,把有机物分为脂肪族化合物和芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
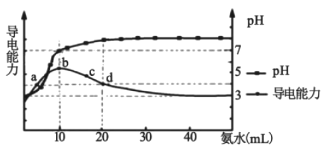
A. 各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B. 常温下,R- 的水解平衡常数数量级为10 -9
C. a点和d点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率与平衡常数均增大
B.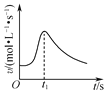 如图是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
如图是镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
C.反应2HI(g)H2(g)+I2(g),达到平衡后,缩小容器容积可使体系颜色变深。该现象不能用勒夏特列原理解释
D.若反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是__________________。
(2)步骤③加的试剂为_____________,此时溶液pH要调到5的目的_______________ 。
(3)写出反应④的离子反应方程式______________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程式_________________。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,我国科研团队研发出一种蓝藻人造叶片系统,其核心是一种可以向细胞外分泌蔗糖的蓝藻,其工作原理如图。下列说法不正确的是
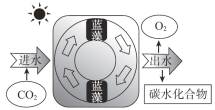
A. 该系统利用了蓝藻的光合作用
B. 理论上,系统出水量小于进水量
C. 可用银氨溶液检验产物中是否含蔗糖
D. 该系统有望为人类探索太空时解决生存难题提供新思路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:① NaHCO3(s)==Na+(ag)+HCO3-(aq) △H=+18.81kJ·mo1-1
②Na2CO3(s)==2Na+(aq)+CO32-(aq)△H=-16.44 k J· mol-1
③2NaHCO3(s)==Na2CO3(s)+CO2(g)+H2O(1) △H=+92.34kJ·mol-1
请回答:
(1)资料显示,NaHCO3固体加热到100℃发生分解,但是加热 NaHCO3溶液不到80℃就有大量CO2气体放出,用反应热角度说明原因_________________________________。
(2) NaHCO3溶液中主要存在2种化学平衡:a.HCO3-+H2O![]() H2CO3+OH-,b.2HCO3-
H2CO3+OH-,b.2HCO3-![]() CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):
CO32-+H2O+CO2。根据理论计算0.10 mol·.L-1 NaHCO3溶液中2个反应的转化率随温度变化如图所示(不考虑相互影响):

①计算25℃0.10mol·L-1NaHCO3溶液中CO2与H2CO3的总浓度最大可能为___________mol·L-1。
②加热蒸干NaHCO3溶液最后得到的固体是___________。
③25℃时0.10mol·L-1的NaHCO3溶液pH=8.3,加热到4分钟溶液沸腾,后保温到7分钟。已知常温下Na2CO3溶液浓度和pH的关系如下表(忽略温度对Kw的影响):
c(mo1·L-1) | 饱和 | 0.20 | 0.10 | 0.010 | 0.0010 |
pH | 12.1 | 11.8 | 11.5 | 11.1 | 10.6 |
请在图中作出 NaHCO3溶液pH随时间变化曲线______________

II.研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图

(1)T℃时,向1L恒容密闭容器中充入0.3 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
C2H4(g)+2H2(g),达到平衡时,c(C2H4)=c(CH4
(2)列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=___________(用平衡分压代替平衡浓度计算,1g0.05=-1.3)
(3)由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Fe2+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O72-转移4.8 mol e-,该反应离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃(PMMA)是一种具有优良的光学性、耐腐蚀性的高分子聚合物,其合成路线之一如图所示:

请回答下列问题:
(1)写出检验A中官能团所需试剂及现象__、__。
(2)用系统命名法给B命名__。
(3)写出C与足量的NaOH乙醇溶液,在加热条件下反应的化学方程式__。
(4)写出E生成PMMA反应的化学方程式__。
(5)下列说法正确的是__。
a.B的核磁共振氢谱有3组峰,峰面积比为6∶1∶1
b.B→C的反应类型为取代反应
c.D中存在顺反异构
d.1molPMMA发生水解反应时消耗1molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com