
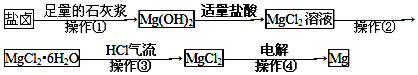
| A. | 操作①--③是为了获得无水氯化镁 | |
| B. | 操作④发生了氧化还原反应 | |
| C. | 操作②是冷却结晶 | |
| D. | 若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
分析 A.操作①发生的反应为沉淀镁离子的反应,加入适量盐酸,操作②是MgCl2溶液得到MgCl2晶体,操作③是获得无水氯化镁;
B.氧化还原反应的特征是元素化合价的升降,操作④为氯化镁电解生成镁和氯气;
C.从溶液中分离出氯化镁晶体采用蒸发浓缩冷却结晶的方法;
D.过滤操作中需要使用漏斗和烧杯、玻璃棒.
解答 解:A.盐卤加入足量石灰浆沉淀镁离子生成氢氧化镁沉淀,过滤得到沉淀加入适量盐酸溶解得到氯化镁溶液,通过蒸发浓缩结晶得到氯化镁晶体,在氯化氢气流中失水得到固体氯化镁,故A正确;
B.操作④为氯化镁电解生成镁和氯气,镁、氯元素化合价都发生变化,属于氧化还原反应,故B正确;
C.氯化镁为溶解度受温度影响较小的盐,MgCl2溶液得到MgCl2晶体需要蒸发浓缩冷却结晶,故C正确;
D.操作①为过滤,需要的玻璃仪器有漏斗、玻璃棒和烧杯,玻璃棒起引流作用,故D错误;
故选D.
点评 本题考查元素及其化合物,明确流程中发生的化学反应是解答的关键,注意镁及其化合物的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
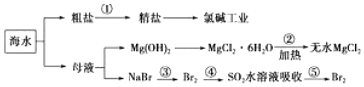
| A. | 工段②是风化过程 | |
| B. | 在工段③④⑤中溴元素均被氧化 | |
| C. | 工业上电解熔融状态下的氯化镁制取镁单质 | |
| D. | 工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
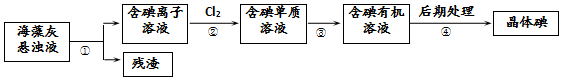
| A. | 步骤④的操作是过滤 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤①、③的操作分别是过滤、萃取 | |
| D. | 步骤③中加入的有机溶剂乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氮气和NA个一氧化碳分子的质量相等 | |
| B. | NA个O2分子和NA个O3分子的质量相等 | |
| C. | NA个O2和NA个H2的质量比为16:1 | |
| D. | 质量同为16 g的O2、O3中都含有的氧原子数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
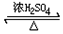 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
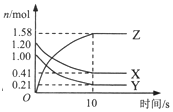 在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )
在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )| A. | 反应开始到10s时,转化率:Y>X | |
| B. | 若前10s容器内的压强增加,说明生成Z的反应为放热反应 | |
| C. | 由图象可知前10s内生成Z的速率越来越快 | |
| D. | 若X为紫色,Y、Z无色,则10s后混合气体颜色不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com