
�������л�ѧ����Ҫ���յ������ֱ�Ϊ��H��H��436 kJ/mol��F��F��153 kJ/mol��H��F��565 kJ/mol������˵����ȷ����(����)
| A��H2��F2��Ӧ���Ȼ�ѧ����ʽΪ�� �� H2(g)��F2(g)=2HF(g)����H����541 kJ |
| B��2 L HF����ֽ��1 L H2��1 L F2����541 kJ������ |
| C��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��541 kJ |
| D������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF��������� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ȼ�ѧ����ʽ��ȷ����(����)
A��2SO2��O2 2SO3����H����196��6 kJ��mol��1 2SO3����H����196��6 kJ��mol��1 |
| B��C(g)��O2(g)=CO(g)����H��393��5 kJ��mol��1 |
C��H2(g)��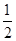 O2(g)=H2O(g)����H����241��8 kJ O2(g)=H2O(g)����H����241��8 kJ |
| D��2H2(g)��O2(g)=2H2O(l)����H����571��6 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�й��Ȼ�ѧ����ʽ��д���Ӧ��������ȷ���ǣ� ��
| A��ϡ������0��1 mol��L-1NaOH��Һ��Ӧ��H+��aq��+OH����aq��= H2O��l����H = -57��3 kJ��mol-1 |
| B����101KPa��������ȼ���ȡ�H =��285��5 kJ��mol-1�� ��ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O��l��=2H2��g��+O2��g�� ��H = +285��5 kJ��mol-1 |
| C����֪2C��s��+O2��g��=2CO��g�� ��H=��221 kJ��mol-1�� ���֪C��ȼ����Ϊ110��5 kJ��mol-1 |
| D��1mol������ȫȼ������Һ̬ˮ����Ϊ285��8kJ��������ȼ�յ��Ȼ�ѧ����ʽΪ2H2(g)��O2(g)��2H2O(g�� �� H����285��8 kJ�� mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�£�H2NNH2����һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯��ͼ��ʾ����֪����1mol��ѧ�������������kJ����N��NΪ942��O=OΪ500��N?NΪ154�������1molN?H�������������kJ����
| A��194 | B��391 | C��516 | D��658 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪���з�Ӧ���Ȼ�ѧ����ʽ��
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ��H1
2 H2(g)+ O2(g)= 2H2O(g) ��H2
C(s)+ O2(g)=CO2(g) ��H3
��Ӧ4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)�ġ�HΪ
| A��12��H3+5��H2-2��H1 | B��2��H1-5��H2-12��H3 |
| C��12��H3-5��H2-2��H1 | D����H1-5��H2-12��H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͼΪij��Ӧ���ʱ�ʾ��ͼ�������йظ÷�Ӧ��˵������ȷ����(����)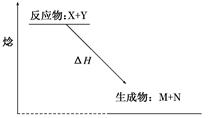
| A����H>0 |
| B��X����һ������M |
| C���÷�ӦΪ���ȷ�Ӧ |
| D���÷�Ӧһ�����ؼ��ȾͿ��Է��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪2Zn(s)��O2(g)=2ZnO(s)��H����701.0 kJ��mol��1
2Hg(l)��O2(g) 2HgO(s)��H����181.6 kJ��mol��1
2HgO(s)��H����181.6 kJ��mol��1
��ӦZn(s)��HgO(s)=ZnO(s)��Hg(l)�Ħ�HΪ(����)
| A����519.4 kJ��mol��1�������� | B����259.7 kJ��mol��1 |
| C����259.7 kJ��mol��1 | D����519.4 kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪���з�Ӧ�ķ�Ӧ��:
(1)CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l)����H1="-870.3" kJ��mol-1
2CO2(g)+2H2O(l)����H1="-870.3" kJ��mol-1
(2)C(s)+O2(g) CO2(g)����H2="-393.5" kJ��mol-1
CO2(g)����H2="-393.5" kJ��mol-1
(3)H2(g)+O2(g) H2O(l)����H3="-285.8" kJ��mol-1
H2O(l)����H3="-285.8" kJ��mol-1
�����з�Ӧ�ķ�Ӧ��Ϊ(����)
2C(s)+2H2(g)+O2(g) CH3COOH(l)
CH3COOH(l)
| A����H="+488.3" kJ��mol-1 | B����H="-244.15" kJ��mol-1 |
| C����H="-977.6" kJ��mol-1 | D����H="-488.3" kJ��mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ȵ��ļ���,�ܺ���һ�ڱ��������Ƿdz��������顣Ŀǰ,һ���˳ơ�ҡҡ�����ļ��伴�������Ѿ����С���ν��ҡҡ����,��ָ��ʳǰ�����ϸ�����е��������ʺ�ˮ���ҡ����ʹ����������ȴ�������������ʿ���������������ѡ��,��Ӧ����( )��
| A���Ȼ��� | B����������� | C������������ | D�������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com