
| A. | C6H14+9O2→CO+5CO2+7H2O | B. | C6H14+7O2→5CO+CO2+7H2O | ||
| C. | C6H14+8O2→3CO+3CO2+7H2O | D. | 2C6H14+15O2→8CO+4CO2+14H2O |
分析 由pV=nRT可知,等温定容条件下,P与n 成正比关系,120℃时测得反应前后气体压强分别是108kPa和156kPa,压强之比是$\frac{108}{156}$=9:13,则反应前后气体的物质的量之比也是9:13,注意该温度下水为气体,结合方程式中计量数来解答.
解答 解:由pV=nRT可知,等温定容条件下,P与n 成正比关系,120℃时测得反应前后气体压强分别是108kPa和156kPa,压强之比是$\frac{108}{156}$=9:13,则反应前后气体的物质的量之比也是9:13,
A.反应前后气体的物质的量比为9:(1+5+7)=9:13,故A选;
B.反应前后气体的物质的量比为7:(1+5+7)=7:13,故B不选;
C.反应前后气体的物质的量比为8:(3+3+7)=8:13,故C不选;
D.反应前后气体的物质的量比为15:(8+4+14)=15:26,故D不选;
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握反应中压强与物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意120℃时水是气态,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 少量铁与稀硫酸反应 | B. | 铁丝在氧气中燃烧 | ||
| C. | 过量铁粉在氯气中燃烧 | D. | Fe投入到CuSO4溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

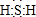 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱O(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组别 | 温度/℃ | V(H2C2O4) /mL | V(KMnO4) /mL | V(H2O) /mL | KMnO4溶液 褪色时间/s |
| 1 | 30 | 10 | 10 | 20 | 40 |
| 2 | 30 | 20 | 20 | 0 | t |
| 3 | 30 | 15 | 10 | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示.X位于元素周期表中第四周期ⅠB族.
A、B、C、D、E、X六种元素的原子序数依次递增,A、B、C的基态原子中L层未成对电子数分别为3、2、1,D是短周期中原子半径最大的主族元素,E是主族元素且与X同周期,E与C可形成离子化合物,其晶胞结构如图所示.X位于元素周期表中第四周期ⅠB族. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com