
| ||
| △ |
| ||
| △ |
| 3000g×64% |
| 64g/mol |
| 1 |
| 2 |
| 15mol |
| 1.0mol?L-1 |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
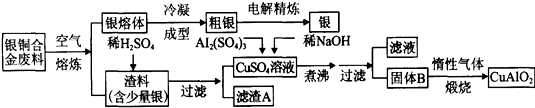
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO + Al2O3 CuAlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(广东卷带解析) 题型:填空题
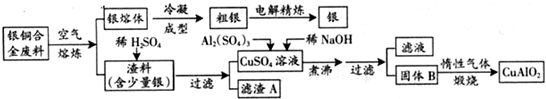
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下: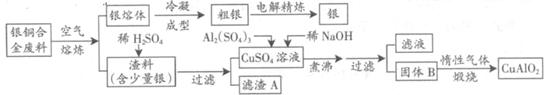
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3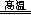 CuAlO2 + ↑。
CuAlO2 + ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol?L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源:2014届河南省原名校联盟高三上学期第一次摸底考试化学试卷(解析版) 题型:填空题
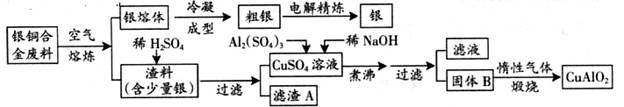
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下图:
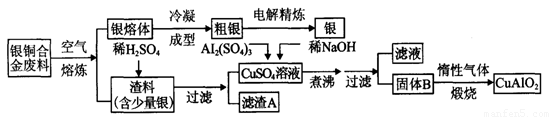
(1)电解精练银时,阴极反应式为_______________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为_______________________________________。
(2)固体混合物B的组成为_____________;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为_____________________。
(3)煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为_____________________。这个反应中会有白烟产生,该白烟为______________。
(4)若银铜合金中铜的质量分数为64%,理论上3.0kg废料中的铜可完全转化为__________molCuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液___________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com